美國臨床實驗室標準協會發布CLSI C62-A臨床質譜新標準
迄今為止,很少能看到有關質譜在臨床診斷中應用的指導規范。美國臨床實驗室標準協會CLSI近來發布了質譜分析方法開發和驗證的標準規程CLSI C62-A指導文件。該文件旨在規范LCMS法,促進其在臨床實驗室中的應用演化。
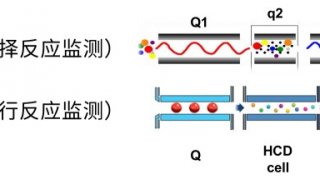
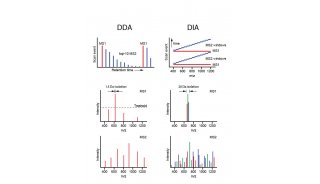
高選擇性和特異性的選擇離子監測模式和精確的確證及定量能力是LCMS在臨床實驗室得以應用的驅動力。LCMS分析特異性優于目前普遍采用的免疫測定法和酶化驗法。免疫法并不能適用于所有分析物,開發過程耗時長,需要對抗體進行評價。正如免疫測定法從50年前開始進化至今天得以成為診斷測試領域占據領導地位的自動化技術一樣,質譜法也會繼續促進和影響臨床實驗室的發展。因此,LCMS應用的標準化是必要的。
質譜法最初應用于臨床僅是由經過良好培訓和有經驗的操作者做專門測試之用。如今,質譜已經成為代謝疾病診斷、疾病篩查、激素含量測定、藥物治療監測、微生物鑒定、藥物毒性和中毒識別等必不可少的工具。如果沒有目前的臨床質譜定量方法,新生兒無法檢測代謝疾病,婦女和兒童睪酮的測定準確度等同于猜測,且大量的化療方法和免疫抑制劑監測也會受到限制。盡管得到廣泛應用,但目前僅有一個定量檢測方法獲得FDA批準。所有其他檢測方法均被FDA納入實驗室自建檢測方法(laboratory-developed test,LDT)類別中。LDT的定義是設計、操作、驗證以及使用在單獨實驗室的體外診斷測試。因此,沒有任何分析同一物質的兩個LCMS方法是相同的。測定同一目標的兩個LCMS方法之間存在的差異性很難一一列舉,其中就包括樣品處理方法、使用的儀器、液相色譜固定相和流動相、質譜離子源、化合物特定參數、離子監測以及最重要的校準品使用。
不幸的是質譜法極少有高標準的標準測定程序和證書參照物可供使用。僅僅最近LCMS分析目標物才開始逐漸增加基于準確度的性能驗證,然而這些僅僅適用于維生素D、雌二醇和睪酮。
CLSI C50提供了關于質譜的總體認識和在臨床實驗室應用的原則,但沒有提供方法開發和驗證的系統路徑。在CLSI C62-A指南發布之前,臨床實驗室開發本實驗室的質譜方法并進行驗證時常依照其它工業標準,例如FDA的“Guidance for Industry: Bioanalytical Method Validation”以及歐盟藥品管理局EMA的“Guideline on Bioanalytical Method Validation”或者“Scientific Working Group for ForensicToxicology Standard Practices for Method Validation”。雖然這些指南對于質譜臨床實驗室有著極為重要的價值,而且確實為CLSI C62-A的制定提供了幫助,但它們不能表現臨床檢測的特殊需求,例如medical decision points,生物變異,總容許誤差,質量控制監測。
隨著質譜技術臨床實驗室應用的增長以及使用該技術的人群更加廣泛,穩定和規范LCMS的需求也在增加。CLSI C62-A列出了臨床實驗室質譜執行規范的重要內容。表1中三個指南有很多相似處,但新的指南能提供更加全面的評價方法。臨床上每一個分析項目開展都需要有相應的驗證條款,CLSI C62-A指南希望為所有分析項目提供一個共同的驗證路徑框架,以確保所有的LCMS方法經過合理的驗證并符合標準接受準則。
CLSI C62-A認為規范化的第一步是建立計量學溯源性至穩定的參照物。
FDA正在著手開展并最終執行LDTs風險系統評價。在FDA重申其對LDTs的控制權力之際,CLSI C62-A指南的出臺非常及時。FDA提議的規程可能會導致對FDA認可的質譜方法需求的增加。
表 1. CLSIC62-A 同FDA美國食品和藥品管理局、EMA歐洲藥品管理局生物分析方法學驗證指南對比
(登錄后,點擊圖片查看大圖)
(登錄后,點擊圖片查看大圖)