用競爭性聚合酶鏈反應(PCR)對細菌定量
摘要:本文描述了在各種不同的生物樣品中確定細菌總量及某一特定菌種的量的快速、經濟的cPCR方法。結果顯示cPCR方法適合進行細菌定量同時也可以作為可靠的細菌檢測方法。內標法中競爭DNA的量可以調節避免了假陰性的出現同時還允許自己設定陽性的閾值。
Abstract:Rapid, cost-effective cPCR methods are described for the determination of the total bacteria count as well as the number of cells of a certain species in a variety of biological samples. cPCR methods are shown to be suitable for quantification and also for the reliable detection of bacteria. The addition of adjustable amounts of competitor DNA for intemal calibration avoids false negatives and permits the setting of a defined threshold over which positive signals are recorded.
在醫學和獸醫學中,用競爭性聚合酶鏈反應(PCR)對細菌定量有關生物樣品中細菌的總量及微生物菌群的組成對評估傳染性疾病、診斷感染以及預見和監測它們的臨床表征十分重要。在其他領域中,包括釀酒業、化妝業和廢水處理業也需要快速經濟的方法來確定細菌的量。
可用來檢測和確定細菌總量的核酸方法許多方法可以用來直接或間接地檢測和確定細菌的總量。其中包括顯微鏡的方法、細菌培養技術、檢測特征性代謝產物和用特異性抗體測定表面分子等方法。最近發展出一些核酸的方法來檢測和確定細菌總量。隨著對不同細菌系同源基因DNA序列知識的不斷積累,這些方法已成為學術研究及微生物的日常檢測中越來越有用的工具。
在所有這些基于DNA的方法中,聚合酶鏈反應(PCR)能提供最高度的特異性和敏感性。PCR技術不僅能夠檢測出痕量的核酸,而且還能根據DNA模板生產出和模板一模一樣的制備量的DNA,供進一步研究使用。
大多數檢測細菌的PCR方法都是針對165S rRNA基因序列的。雖然這些方法可以很容易地設計成具有高度特異性,但是它們卻無法定量。經典的PCR方法只是一個定性的方法[1]。因為它的指數級放大倍數以及同樣指數級放大的偏差使從大量的PCR產物中確定DNA樣品(模板)的量成為不可能。
在過去的幾年中,人們做了許多嘗試對PCR進行適當的控制以使其能夠定量。在文獻上所描述的各種各樣的定量PCR方法中,有一類依靠外部標準,另一類則依靠內部標準[2,3]。在后一類中,競爭性PCR(cPCR)方法是最穩定可靠的。它們是基于靶DNA與一個同源或異源DNA標準共擴增,這些基因與樣品模板DNA競爭同一套PCR引物[2]。因為加入到反應混合物中的競爭物的量是已知的,所以能夠從樣品和競爭物DNA的擴增產物之比計算出靶DNA的量。
本文描述了確定細菌總量的cPCR方法的發展與應用。只要得到群特異定量PCR方法就能很容易地用該方法給不同來源的生物樣品中的特定菌群定量[4,5]。
1 實驗
1.1 細菌特異性定量PCR的開發
用Multalin方法[6]對比了隨機選擇的近100個菌群的16S rRNA基因序列,選擇高度保守的序列構建細菌特異性cPCR。設計了兩種引物,每一種都與一個保守的序列區結合一個是正向引物5’-ACTACGTGCCAGCAGCC一3’,一個是反相引物5’-GACTACCAGGGTATCTAATCC-3’。希望這些引物對幾乎所有的細菌群都能產生296?300個堿基對的PCR產物[5]。
在cPCRs中,設計合成了一個同源競爭物作為DNA標準。為了使從樣品模板和競爭物得來的PCR產物易于分離,設計的競爭物比模板要短一些。對細菌特異的cPCR,競爭物是通過用E.coli基因DNA作為模板。用一個prbre引物和一個與模板內部的3部分結合的雜交引物擴增獲得的。用于校準cPCR方法的PCR產物,包括同源競爭物,在260 nm處吸收測量定量。
所有的PCR反應的總體積均為50pL,在一個0.2mL的試管中進行。模板中每種引物各加40pmol。再加入0.1μmol MgCl2,2.5nmol各種脫氧核營三磷酸,1.25U Thermus aquaticus聚合酶,5μL 10 x Taq緩沖液,加水補充至50pL。PCR擴增在GeneAmp 2400DNA thennalcycler上完成。最開始的變性溫度為95℃,變性10min,接下來做40個循環,95℃變性,66℃引物退火和延伸,每個步驟30s。擴增產物存于?20℃。用電泳法檢測擴增子(10μL PCR產物在2%瓊脂糖上)電泳時電壓為10V/cm,緩沖液為TBE。DNA用溴化乙錠染色然后用E.A.S.Y.視頻凝膠記錄系統進行視頻密度計量定量,用254nm紫外光作透射光。
1.2不同來源生物樣品的cPCE方法應用
唾液樣品中細菌總量的測定如下對一個志愿者,連續4天內停止所有的口腔衛生清洗。在第一次取樣前進行一次專業洗牙。然后在早晨8點、中午12點、下午6點飯前分別用10mL無菌去離子水沖洗口腔來獲得唾液樣品。在第4天上午8點取樣后再進行一次專業洗牙。樣品進行分析前貯存于?20℃。在PCR前,用渦流振蕩和超聲使樣品重新懸浮。cPCR需使用樣品2μL。
1.3人白細胞濃縮液
分析了20份無菌白細胞濃縮液。每份樣品都補充已知量的競爭物,然后用苯酚抽提/乙醇沉淀,并按上述方法進行cPCR。
1.4人白細胞濃縮液的人工感染
在白細胞濃縮液中加入已知量的不同細菌進行感染,在每1mL新鮮的白細胞濃縮液中分別加入5xl06的每種菌種。樣品貯于?20℃作為陰性對照或在37℃下孵育過夜。樣品的準備和cPCR測定過程均如前所述。
1.5 城市廢水
在廢水的cPCR樣品內加入已知量的競爭物,然后用苯酚抽提,乙醇沉淀,cPCR測定過程如上所述。
1.6 參照方法
用培養技術作確定白細胞濃縮液、廢水和唾液樣品中細菌總量的參照方法。將直接顯微鏡下的細胞計數用作口腔洗液樣品的參照方法。
2結果與討論
2.1 細菌DNA和細菌總量的cPCB測定
為了證明cPCR方法的實用性,建立了兩套為細菌DNA定量的校正曲線。這些曲線是用不同量的PCR產物共擴增得到的,這些PCR產物是在引物prbfo和prbre及恒定量的同源競爭物存在下擴增得到的。因為1個E.coU細胞含有7個16S rRNA基因拷貝[7],所以對于用定量的PCR為細菌進行量化而言,7個分子的競爭物就相當于1個細胞。
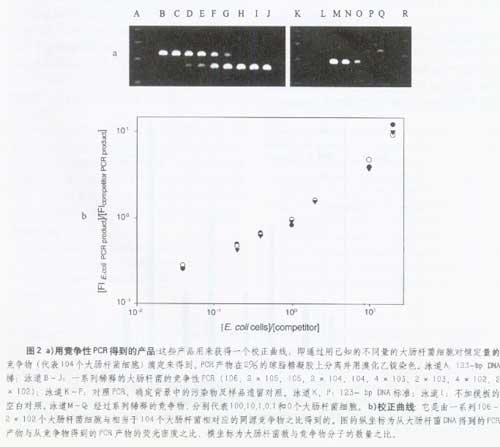
為了證明這個方法對細菌細胞定量的實用性,用一系列E.coh細胞稀釋液與已知量的同源競爭物共擴增得到校正曲線。圖2a為PCR產物的瓊脂糖電泳結果。這些產物是由一系列106?102個E.coli細胞稀釋液與恒定量(與104個E.coli細胞稀釋液相當)的同源競爭物共擴增得到的。圖2b是一個3倍的視頻密度計量分析結果。每一次PCR循環,根據所加入的競爭物量的不同,該定量方法可適用于測定101?106個細菌細胞。該方法的靈敏度受到Taq聚合酶中存在的痕量細菌DNA的影響。即使非常細心地準備,這些痕量細菌DNA的存在也能導致在空白組中生成PCR產物。在使用溴化乙錠染色的PCR方法中,空白組通常顯示出一條很弱的帶。因此用很低量的同源競爭物滴定空白對照組確定背景細菌DNA的量十分重要。在每次實驗中都要做這一步。細菌的擴增一般在同源共聚物相當于10?100E.coli時受到抑制。更多量的細菌DNA的存在表明有污染。此時整個實驗必須廢棄。
通過這些實驗可以看出,cPCR適用于DNA定量也適用于細菌定量。在為細菌定量中,存在的主要問題就是如何選擇一個合適的條件破壞細菌。人們發現在cPCR中7?10min的最初變性時間及短于1kb的PCR產物能夠直接為所有的被調查的菌群定量。cPCR結果與顯微鏡計數細胞相比較表明,在這些條件下,16S rRNA基因的5?6個拷貝可以用在E.coli和其它細菌中進行PCR擴增。
2.2不同生物樣品中細菌總量的確定
在口腔停止衛生清洗實驗中,唾液中細菌總量的測定是通過口腔沖洗來實現的。圖3給出了細菌總量與時間的關系曲線。在口腔停止清洗實驗中,細菌量逐漸增加并于恢復清洗后顯著下降。在這個和其它的相關研究中,證明cPCR能夠快速有效地監測細菌量的變化并能快速有效地評估各種口腔衛生措施的有效性。
cPCR還可應用于可疑的人白細胞懸液的細菌感染的檢測。對白細胞濃縮液或其它血液制品進行cPCR分析的一個問題是Taq聚合酶抑制物的存在。PCR抑制物能夠導致擴增產物的丟失。在標準PCR中,這個結果與靶DNA缺失所得到的結果無法區分,這將導致錯誤結果(假陰性)。在cPCR中,樣品模板的缺失會導致競爭物的信號非常強烈,而PCR抑制劑則既阻止了樣品的擴增也阻止了競爭物的擴增,這樣就很容易將兩者區分開來。因為PCR抑制劑可能存在且需檢測的白細胞濃縮液中細菌DNA的量非常低,因此需要一個PCR預處理過程來分離和濃縮靶DNA。靶DNA可以得到500倍濃縮。在cPCR分析中,所有被檢測的白細胞樣品中都不含細菌DNA。為了證明該結果的準確性,用3種不同的細菌體外感染人白細胞濃縮液。用E.coli、Lactobacillus spp及S.mutans感染白細胞濃縮液的結果顯示,這3種細菌在白細胞濃縮液中的生長行為不同。通過用cPCR方法分析新鮮感染的白細胞濃縮液可以確定相對于接種細胞量的細菌數。感染樣本在37℃下培養過夜,與對照樣本(感染,然后貯存于?20℃中)相比較E.coU細胞的量增加了3倍,Lactobacillus spp增加了2倍,s.mutans增加了5倍。
cPCR方法還應用于城市廢水樣品,確定其中的細菌總量,結果列于表l。這些結果顯示cPCR對這些重度污染樣本有重要的應用價值。用cPCR獲得的結果與用培養的方法獲得的結果加以比較可以看出,在大多數樣品中用cPCR方法測定的結果稍微高一些。這可能是因為培養的方法只能確定活細菌的量,而cPCR則包括了所有的活細菌以及剛剛死的但仍含有擴增DNA的死細菌。
3 結論
快速和經濟的cPCR方法可以成功地用于檢測各種生物樣品中的細菌總量以及細胞數。cPCR方法適合為細菌定量,同時也是一種可靠的細菌檢測方法。對內標準法,加入的競爭物DNA的量可調,這不僅避免了樣品中存在的Taq酶抑制劑引起的假陰性而且還可以設定陽性信號的閾值。
參考文獻:
- Mullis K, Faloona F, Scharf S, Saiki R, Hom G, Erlich H. Specific enzymatic amplification of DNA in vitro:dle polymerase chain reaction. Cold Spring Harb Symp Quant Biol 1986; 51(I):263-73.
- Sieben PD.Quantitative PCR. Methods & applications,book 3. Palo AIto, CA: Clontech Laboratories, Inc.,1993.
- Zimmermann K, Mannhalter JW. Technical aspects of competitive quantitative PCR. Biotechniques 1996;2 l :268-72,274-9.
- Rupf S, Kneist S, MeHe K, Eschrich K. Quantitative determination of Streptococcus mutans by using competitive polymerase chain reaction. Eur J Oral Sci 1999;107:75-81.
- Rupf S, Mene K, Eschrich K. Quantification of bacteria in oral samples by competitive polymerase chain reaction. J Dent Res 1999;78:50-6.
- Corpet F. Multiple sequence alignment with hierarchical clustering. Nucl Acids Res 1998;16: 1O,881-90.
- King TC, Schlessinger D. Ptocessing of RNA transcripts.In Escherichia coli and Salmonella typhimurium.Cellular and molecular biology. Neidhard FC, ed.-in-chief, Ingraham JL, Brooks Low K, Magasanik B,Schaechter M, Umbarger HE,eds. Washington, DC:American Society for Microbiology, vol. l, 1987:pP.703-18.
相關閱讀:
- 香港中文大學獲一生物公司RT-PCR系統ZL (admin, 2007-5-31)
- 羅氏診斷和默克化工參展BIOTECH CHINA 2008 (laurie_dly, 2008-2-22)
- 實時定量PCR完全手冊 (UUBird, 2008-3-26)
- 淺談PCR方法中常見的污染問題及對策 (UUBird, 2008-3-26)
- PCR污染與對策 (blue-candy, 2008-3-26)
- 分子生物學實驗室常用儀器使用方法與保養 (實驗技術, 2008-3-26)
- PTC-225型PCR儀操作規程 (實驗技術, 2008-4-02)
- 熒光定量PCR全攻略 (UUBird, 2008-4-09)
- 應用RNAi 檢測黑胃果蠅中基因的功能 (UUBird, 2008-6-09)
TAG: pcr