實用!動物實驗專題——AAV如何實現精準靶向感染(心血管研究必收藏)

2020年9月11日,國家心血管病中心發布了《中國心血管病健康和疾病報告2019》,報告顯示中國心血管病現患人數3.3億,其中腦卒中1300萬,冠心病1100萬,肺原性心臟病500萬,心力衰竭890萬,風濕性心臟病250萬,先天性心臟病200萬,下肢動脈疾病4530萬,高血壓2.45億。《報告》顯示,中國心血管病患病率處于持續上升階段,心血管疾病仍是造成死亡的重要因素。
心血管研究一直是生命科學和醫學中的熱點方向。吉凱始終助力臨床醫生在心血管疾病上的轉化研究,產品/服務曾登頂多個頂級期刊如,Nature Medicine、Circulation、Cell Metabolism、Journal of Extracellular Vesicles、Circulation Research、Journal of Pineal Research、Nature Communications、Leukemia、Blood等。(了解最新心血管領域文獻,請點此查閱)
今天小編邀請大家一起學習AAV在心血管系統研究中的基因轉導及組織特異性表達策略。
想了解AAV在更多系統中的體內應用,請關注本周五的免費線上講座!掃碼即可報名


一、心血管系統AAV血清型的選擇

現有研究當中AAV1、AAV2、AAV6、AAV8和AAV9型均有應用于心臟方向的研究,有文獻報道[1],一周齡小鼠通過系統性的注射方式(頸靜脈注射)不同血清型、不同病毒總量AAV,四周后檢測感染心肌細胞感染情況,結果表明,AAV8和AAV9對心臟的感染效率高于其他血清型:

圖1. 不同血清型、不同劑量AAV感染小鼠心臟表達情況對比[1]

二、心血管系統AAV啟動子的選擇

常規2型啟動子在心臟中已有較好的表達,表達效果已經可以滿足大多數實驗需求,如果沒有組織特異性感染的要求,可以選擇CMV啟動子:

圖2. 吉凱客戶文獻[2]:Circular RNA CircMAP3K5 acts as a microRNA-22-3p sponge to ?promote resolution of intimal hyperplasia via TET2-mediated SMC differentiation(IF=29.690)
病毒設計:CircMap3k5過表達AAV,CMV啟動子
實驗分組:實驗組注射過表達腺相關病毒AAV9-pCMV-CircMap3k5 ,對照組注射對照腺相關病毒AAV9-pCMV-empty
動物選擇:10-12 周齡雌鼠(20-25 g) ,Tet2flox/flox(stock No.009380, Jackson Laboratory) 工具鼠及野生型小鼠
注射劑量:靜脈注射,病毒滴度1×1012 vp/ml, 注射體積50 μl/只
如果需要實現目的基因在心臟中的特異性表達,需構建裝載特異性啟動子或使用組織特異性血清型的AAV以實現目的基因在心臟或者血管中的特異性表達,比較常見的有心肌細胞特異性啟動子cTNT以實現心肌細胞的特異性表達、血管內皮細胞特異性啟動子Tie2以實現內皮細胞的特異性表達,具體如下。

三、組織特異性調控策略:
啟動子&血清型

心肌細胞特異性調控
使用心肌細胞特異性啟動子cTNT,可以突破注射方式的局限,即使使用簡便的系統性注射方式,也可以實現心肌細胞的特異性表達,以如下頸靜脈注射方式為例,裝載有cTNT啟動子的AAV可以實現心肌細胞的特異性感染,并且在其他器官中,未檢測到目的基因的表達。

圖3. 吉凱客戶文獻[3]:Ischemic Heart-Derived Small Extracellular Vesicles Impair Adipocyte Function(IF=17.367)
病毒設計:GV618載體,cTNT啟動子
實驗分組:實驗組腺相關病毒miR-23-27-24 sponges,對照腺相關病毒NC sponges
動物選擇:6-8周齡小鼠
注射劑量:頸靜脈注射,病毒劑量3×1011 genomes (vg)/只), 注射體積50 μl/只,4周后檢測EGPF表達情況
血管內皮細胞特異性調控
為了實現內皮特異性,我們主要通過組織特異性血清型和內皮特異性啟動子兩個方面實現:
(一) 內皮特異性血清型:sig和ENT
1. sig血清型:是在2型的AAV上插入了EC靶向肽SIGYPLP;
2. 內皮高轉導血清型ENT:是通過AAV9衣殼A589位點插入一個七肽SLRSPPS,使其對內皮細胞的感染效率顯著增高。
感染效果 | ||
常規血清型 |  圖4. 使用rAAV血清型1和5用于血管靶向的基因遞送有顯著優勢,但上述血清型還會對平滑肌及其他臟器有著較強的感染效率,限制了其在基因治療上面的進一步應用[4]。 | |
內皮特異性血清型sig |  圖5. 與文獻報道傳統2型相比,AAV-sig臍動脈內皮表達增加約為5.9倍,對隱靜脈內皮細胞增加約28.2倍[5]。 | |
內皮高轉導血清型ENT | 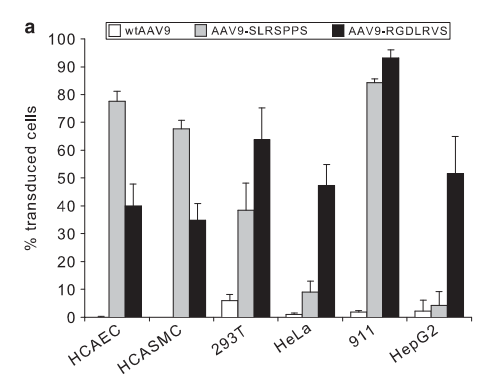 圖6. 在冠狀動脈內皮細胞(HCAECs);人冠狀動脈平滑肌細胞(HCASMC);肝腎等來源的永生化細胞(HEK293T,HeLa,911,HepG2)中rAAV9插入肽有效地提升了對內皮細胞的感染效率,但不具有內皮細胞靶向性[6]。 | |
(二) 內皮特異性啟動子:TIE和ICAM2
其實不管是選擇組織特異性血清型或者組織特異性啟動子,所呈現的特異性其實也不是絕對的,只是增加內皮細胞的感染效果,組織特異性血清型使用的同時,也可以同時選擇組織特異性啟動子。
1. ICAM2啟動子
人細胞間粘附分子2(ICAM-2)表達局限于血管內皮細胞和巨核細胞,Cowan6鑒定了該基因0.3k的啟動子,并驗證了其內皮細胞特異性。
2. TIE啟動子
另外一種內皮特異性啟動子來源于酪氨酸激酶受體TIE1/2基因,與ICAM-2調控原理類似,在內皮的特異性主要由PEA3基序決定。
以TIE2啟動子為例,通過尾靜脈注射的方式,可以實現血管內皮細胞的特異性感染,下圖為動脈粥樣硬化Apoe?/?小鼠模型中注射TIE2血管內皮細胞特異性AAV,通過免疫組化及westernblot檢測各組主動脈內皮細胞Bcl-2蛋白水平,并用β-肌動蛋白定量,實驗結果如下圖所示:
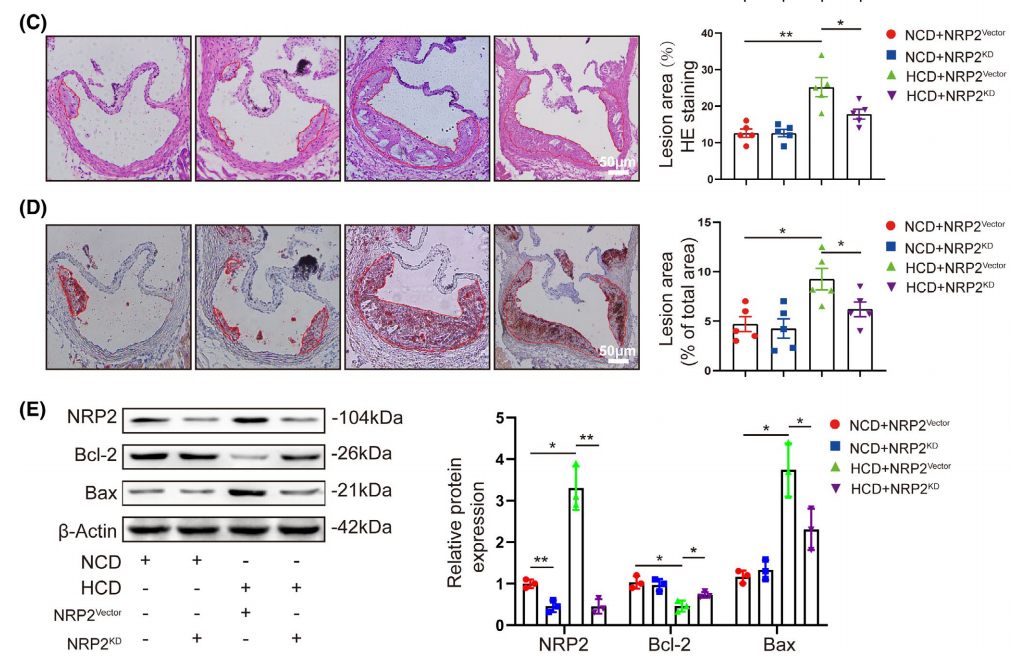
圖7. 吉凱客戶文獻[7]:NRP2 promotes atherosclerosis by upregulating PARP1 expression and enhancing low shear stress-induced ?endothelial cell apoptosis
病毒設計:NRP2敲減腺相關病毒rAAV-tie2-mCherry-5′miR-30a-shRNA(NRP2)-3′miR-30a-WPREs,TIE2啟動子
實驗分組:分為4組(每組15只小鼠):NCD+NRP2KD、NCD+NRP2KD、HCD+NRP2KD和HCD+NRP2KD
動物選擇:8周齡Apoe?/? 雌鼠 (動脈粥樣硬化小鼠)
注射劑量:尾靜脈注射,病毒滴度2×1012 genomes /ml, 注射體積100 μl/只,8周后生成血管斑塊。實驗組在喂食8周HCD后檢測量各種指標
實驗結果:AAV介導的NRP2基因敲除可減輕體內動脈粥樣硬化斑塊的形成和EC凋亡

四、心血管系統注射方式

心血管主要有心臟和血管組成,在使用工具病毒感染心臟或血管時常用的注射方法主要有尾靜脈注射、心肌定點注射、心包內注射、血管夾閉注射等,具體操作方法介紹如下:
心肌定點注射
1.實驗前準備
準備內容:常規手術器械、靜脈留置針、氣官插管、10ml注射器、縫合線、剃毛器、呼吸機、體重秤、微量注射器、干棉球、1%的戊巴比妥、胰島素注射針、小鼠、病毒、碘伏、75%酒精、金霉素眼膏、PBS。
a. 麻醉:小鼠稱重后腹腔注射1%的戊巴比妥(劑量為80mg/kg體重),放置于飼養籠內,約5~10 min;
b. 固定:待小鼠完全麻醉后,將其固定在操作臺面,用門齒環固定頭部,眼部涂抹金霉素眼膏以保持濕潤;
2.心臟暴露及固定
a. 使用鑷子將小鼠舌頭拉出,然后用耳鏡找到聲帶,并引導導絲通過聲帶進入氣管,而后在導絲的引導下將導管置入氣管內;
b. 抽出導絲,利用10ml注射器吹氣觀察肺部變化,確定插管放置位置準確,而后用縫合線將導管固定;
c. 使小鼠處于左側臥位,將氣管內插管與呼吸機連通;
d. 剔除胸部偏左部位的毛發,用酒精和碘伏依次消毒,蓋上手術布,確保手術部位無菌;
e. 在第四肋間隙做一個2厘米的皮膚切口,分割皮下組織和肌肉肌肉,通過第四肋間隙進入胸腔,觀察左膈神經,在不破壞神經的情況下打開心包,露出左心室;
3. 病毒注射
a. 穿過左心室尖端放置一根7–0聚乙烯縫合線,并用一對止血鉗夾住縫合線的兩端;
b. 用胰島素注射針吸取適量病毒載體,用優勢手拿胰島素注射器;
c. 用非優勢手抓住縫合線操控心臟位置,使得最大程度暴露左心室注射位點;
d. 將胰島素注射器針頭插入心肌,回抽確認無回血后注射適量病毒,然后依次注射其它位點(一般3~5個位點,保持位點間距相等,每個位點注射量約5μl);
e. 注射結束后,將18號的靜脈留置針穿過皮膚并經第五和第六肋間隙進入胸腔,抽出針頭。
4. 動物復蘇
a. 依次縫合肋間隙、肌肉組織、皮下組織、皮膚;
b. 皮膚縫合后,將靜脈留置針與10ml注射器相連,拉出活塞至拉動受阻,保持活塞位置,將靜脈留置針和注射器移走;
c. 待小鼠恢復自主呼吸后,關閉呼吸機撤掉氣管內插管,并將大鼠從操作臺上取下放入飼養籠內(可在旁邊放置電暖器),待其蘇醒。
注意事項:
a. 手術后4h和12h注射消炎止痛藥,防止動物因疼痛而抓撓傷口致使開線或傷口感染。
b. 病毒種類不同,其感染擴散范圍不同,要根據注射病毒類型選擇合適的注射位點數。
心包內注射

圖8.心包結構示意圖
1. 實驗前準備
準備內容:新生鼠、250ul注射器、33號針頭、微套管(內徑0.51mm,外徑1.53mm)、病毒、冰、無菌生理鹽水或PBS、培養皿
a. ?裝置準備:在33號針頭上距尖端3mm位置以上位置用微套管覆蓋;
b. ?麻醉:將幼鼠從籠內取出,放入培養皿后置于冰上2~3min,使其麻醉;
2.病毒注射
a. 吸取病毒:用微量注射器吸取足量的病毒,而后更換準備好的33號針頭并輕推排出氣體,放冰上備用;
b. 抓取幼鼠:用非慣用手的拇指和食指捏住幼鼠頸背部皮膚,翻轉手腕使幼鼠腹部朝上,確保能清晰看到胸骨、肋骨和劍突;
c. 注射:用慣用手持微量注射器,自左肋骨劍突角下針,而后將針頭向上沿與左肋骨邊緣平行方向推進3mm(至套管處)停止,緩慢注射50μl病毒液至心包腔,而后緩慢將針拔出;
3. 動物復蘇
將幼鼠放回原鼠籠母鼠身邊,采取適當保暖措施幫助小鼠恢復。
注意事項:
a. 病毒注射時進針操作要輕柔,避免用力過大損傷幼鼠其它臟器或進針過深;
b. 病毒注射完畢,必須要立即采取保暖措施,確保幼鼠體溫快速恢復。
血管夾閉
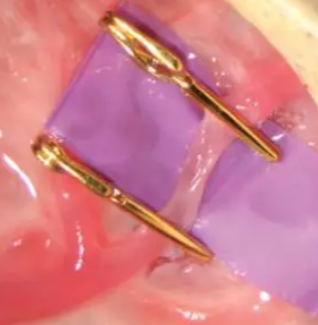
圖9. 血管夾閉示意圖
1. 實驗前準備
準備內容:小鼠、常規手術器械、縫合線、剃毛器、體重秤、微量注射器、干棉球、1%的戊巴比妥、胰島素注射針、碘伏、75%酒精、雙氧水、金霉素眼膏、PBS。
a. 麻醉:小鼠稱重后腹腔注射1%的戊巴比妥(劑量為80mg/kg體重),放置于飼養籠內,約5~10 min;
b. 固定:待小鼠完全麻醉后,將其固定在操作臺面,用門齒環固定頭部,眼部涂抹金霉素眼膏以保持濕潤。
2. 血管暴露
a. 將大鼠頭適當向右偏轉;
b. 用剃毛器將大鼠左側頸部毛發剔除,用酒精、碘伏、雙氧水依次擦拭皮膚消毒;
c. 在頸部偏左位置做一個3cm切口,分離皮下組織、肌肉等,用止血鉗拉開皮膚,暴露出左側頸動脈。
3. 病毒注射
a. 確定好感染目標節段,分別在其遠心端和近心端各夾一個止血夾(根據流向先夾上游),確保血流完全阻滯;
b. 用胰島素注射針吸取適量病毒(約50μl),而后將病毒緩緩注入夾閉的血管節段,30分鐘后拿掉止血夾,恢復血液流通;
4. 動物復蘇
a. 先使用可吸收的4-0縫合線縫合肌肉,然后用5-0縫合線依次縫合皮下組織和皮膚;
b. 將小鼠放回籠內(可在旁邊放置加熱器),待其蘇醒。?
注意事項:
a. 手術后4h和12h注射消炎止痛藥,防止動物因疼痛而抓撓傷口致使開線或傷口感染;
b. 血管夾閉時間越長病毒感染效果越好,但對下游組織的損傷也越嚴重,因此夾閉時間不宜超過半小時。
最后,對以上注射方法特性總結如下表:
靶向器官 | 注射方法 | 優勢 | 不足 |
心血管 | 心肌定點注射 | 病毒用量小,特異性感染注射位點心肌細胞 | 操作要求高,動物損傷大 |
心包注射 | 操作簡單,特異性好 | 注射準確度不好掌握 | |
血管夾閉 | 感染效率高,特異性好,病毒用量小 | 操作要求高,動物損傷大,適用血管有限 | |
尾靜脈注射 | 操作簡單,無損傷 | 病毒用量大,特異性差 |
【參考文獻】
[1] Prasad K ,? Xu Y ,? Yang Z , et al. Robust Cardiomyocyte-Specific Gene Expression Following Systemic Injection of AAV: In Vivo Gene Delivery Follows a Poisson Distribution[J]. Gene Therapy, 2011, 18(1):43-52.
[2] Zeng Z ,? Xia L ,? Fan S , et al. Circular RNA CircMAP3K5 Acts as a MicroRNA-22-3p Sponge to Promote Resolution of Intimal Hyperplasia via TET2-Mediated SMC Differentiation[J]. Circulation, 2020, 143(4).
[3] DOI: 10.1161/CIRCRESAHA.121.320157
[4] Chen S ,? Kapturczak M ,? Loiler S A , et al. Efficient transduction of vascular endothelial cells with recombinant adeno-associated virus serotype 1 and 5 vectors.[J]. Human Gene Therapy, 2005, 16(2):235.
[5] Nicklin S A ,? Buening H ,? Dishart K L , et al. Efficient and selective AAV2-mediated gene transfer directed to human vascular endothelial cells[J]. Molecular Therapy, 2001, 4(3):174-181.
[6] Varadi K ,? Michelfelder S ,? Korff T , et al. Novel random peptide libraries displayed on AAV serotype 9 for selection of endothelial cell-directed gene transfer vectors.[J]. Gene Therapy, 2012, 19(8):800-809.



1.實驗技術干貨
2.蛋白質組學研究
3.腺病毒簡介及應用
8.懸浮細胞專用病毒
10.測序技術研究與應用
13.表觀遺傳研究
14.文章解析
15.國自然課題設計思路解析
17.外泌體研究 ? ?
18.腫瘤免疫研究
19.高分文章 ?