Nature Protocols | “腸-腦軸”靶向代謝組學研究--如何破局?

如果你要寫腸道,就不能只寫腸道。你要寫胃腸道居住著大約5億個神經元組成的腸神經系統產生人體50%的多巴胺和約90%的5-羥色胺影響你的情緒;你要寫超過100萬億個微生物組成的腸道菌群產生的神經遞質γ-氨基丁酸幫你控制恐懼和焦慮;你要寫腸道包含70%的人體免疫細胞幫你免疫各種病原體的侵害;你要寫人體的“第二大腦”腸腦軸(Gut-Brain Axis)......
近期很多腸腦軸的研究人員詢問繪譜君,通過微生物擴增子測序、宏基因組、代謝組學,篩到了與疾病關聯的關鍵細菌和代謝物,后續如何設計實驗進一步確定因果關系?
2023年一篇發表在Nature Protocols“基于LC-MS/MS的靶向代謝組學,通過體外細菌和類器官培養及體內無菌小鼠模型,對哺乳動物腸-腦軸進行研究”的文章給出了研究范式。動物模型在探究大腦和腸道間的雙向交流中發揮著關鍵作用,但目前大部分研究都集中在復雜的微生物群落上,很難確定特定微生物對宿主神經系統的貢獻。作者借助靶向代謝組學、細菌培養、體外(類器官)和體內小鼠模型解析共生微生物和宿主復雜代謝物評估的系統化策略;該方法可專門識別微生物信號 (體外和體內)并將它們與宿主內部的變化相關聯。

哪些微生物驅動宿主代謝物的改變?
胃腸道中有一個豐富多樣的微生物群落,統稱為腸道菌群。腸道微生物群包括厚壁菌門、擬桿菌門、放線菌門、變形菌門和疣微菌門等。腸道菌群在嬰兒出生后不久就會形成,并隨著宿主年齡的增長而波動。在發育早期,嬰兒期腸道通常以放線菌門的雙歧桿菌為主,微生物和宿主在這個重要窗口期之間的相互作用被推測對中樞神經系統(CNS)的正常發育至關重要。青春期后,腸道微生物群被認為是穩定的,主要是細菌門和厚壁菌門。這些衰老過程中成分的變化代表了飲食、環境和潛在的宿主需求的良性循環。除了維持腸道環境外,人們逐漸認識到其對其他遠端器官的影響。過去十年,研究人員已經認識到胃腸道和大腦之間重要的雙向聯系即“腸-腦”軸。腸道微生物通過多種途徑與大腦進行交流:細菌代謝物(如短鏈脂肪酸(SCFAs)和肽聚糖)、神經遞質(如γ-氨基丁酸(GABA)、組胺)、色氨酸代謝、腸內分泌細胞激活、免疫調節及刺激腸神經系統(ENS)和迷走神經。腸道微生物群與焦慮、肥胖、自閉癥、精神分裂癥、帕金森病和阿爾茨海默氏癥的密切聯系體現其在中樞神經系統健康中的作用。哪些微生物驅動了宿主特定中樞神經系統的改變?
基于LC-MS/MS代謝組學方法利用體外(培養基和類器官模型)和體內(單個微生物定植的無菌小鼠)系統檢測細菌代謝物,定量宿主來源的神經遞質和SCFAs。本文選擇兩種人類腸道中常見的齒雙歧桿菌和卵形擬桿菌結合培養基、類器官和已知菌動物解析單個微生物對宿主神經遞質的影響,以明確特定的細菌如何改變腸道和中樞神經系統。
方法步驟概述
1.?微生物模型的工作流程
特定細菌如何改變腸道和中樞神經系統?研究不同類型微生物組模型的一般工作流程由三部分組成:
階段1. 使用培養基生成微生物代謝物來識別微生物來源的神經遞質和SCFAs(步驟1-24);
階段2. 利用小鼠或人類類器官體外研究微生物代謝物對腸上皮的影響,確定產生神經遞質的腸內分泌細胞對細菌產物的反應(步驟25-47);
階段3. 體內研究,使用單個微生物定植的已知菌小鼠進行體內研究,以確定腸道和大腦如何對微生物定植做出反應(步驟48-52)。
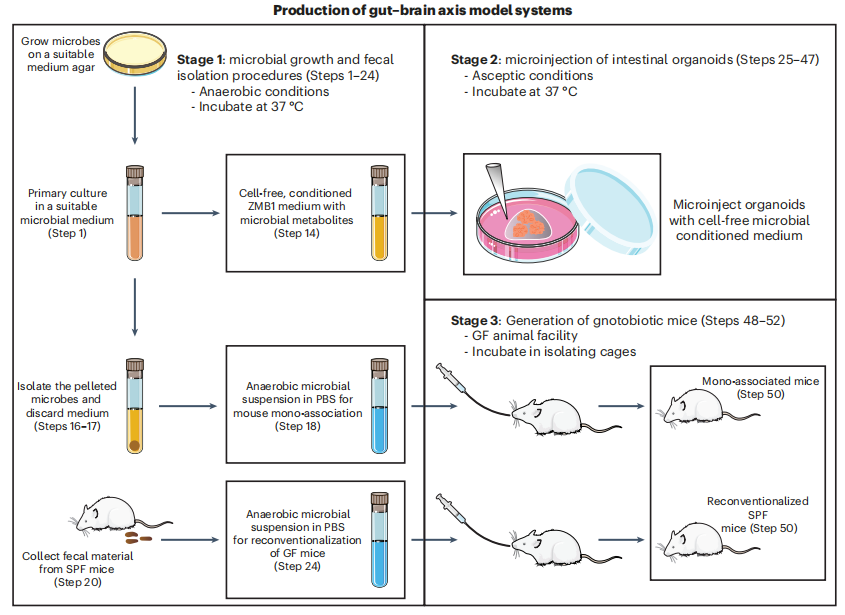
圖1. 不同類型微生物組模型的一般工作流程
2.?各樣品收集方法和前處理步驟
(步驟53-56)介紹采集糞便樣本、安樂死、收集和處理各種組織的過程,包括腦組織(步驟57-69)、腸道內容物(步驟70-79)和糞便(步驟80-86)。
(1)代謝物的無細胞微生物條件培養基(步驟9-14用于微生物培養和條件微生物培養基處理,步驟87B(i-iii)用于色氨酸、酪氨酸途徑和谷氨酸循環分析,步驟87A(i-v)用于培養基中SCFA分析);
(2)含代謝物的無細胞微生物條件培養基注射類器官培養基(步驟25-47);
(3)腸道沖洗(步驟53-54、56和70-79);
(4)腦勻漿(步驟53-54、56和57-69);
(5)糞便樣本(步驟53-55、80-86和附87A(i-ii)和(vi-viii),用于均質糞便樣本提取物中的SCFA分析)。

圖2. 各樣品采集方法和處理步驟
3.?LC-MS/MS靶向代謝組學方法優化
因液相色譜分離具有廣泛的色譜柱選擇和優異的分離技術(如反相(±離子配對),親水交互色譜(HILIC),和離子交換、手性和正相色譜),使用單一的MS儀器平臺可以覆蓋多種物理化學性質的微生物和宿主產生的代謝物。基于LC-MS/MS的靶向代謝組學工作流程使用三重四極桿質譜檢測,標準品和同位素內標(IS)建立標準曲線,進行高精度和準確的定量。圖3a突出顯示了神經遞質的代謝途徑及使用LC-MS/MS方法檢測這些途徑生成的相應色譜圖。圖3b確定了SCFA分析物的衍生化前和衍生化后的化學結構及用于衍生化反應的試劑。
色氨酸和酪氨酸途徑代謝物的定量方法基于反相離子色譜分離,使用含有七氟丁酸的流動相。谷氨酸循環法基于HILIC,使用含有甲酸銨和甲酸的流動相進行流動相緩沖。最后,SCFA方法利用π-π疊加交互聯苯的芳香功能分析柱和芳香環的衍生品產生的衍生化反應分離所有SCFA衍生物。
作者對SCFA、色氨酸、酪氨酸途徑和谷氨酸循環靶向代謝組學方法進行一維方法基準評估,即使沒有酪氨酸、色氨酸、谷氨酸、谷氨酰胺和乙酸的培養基仍表現出高化學背景,干擾幾種代謝物的定量。本研究制備一種可以培養多組生物體的明確培養基且可用于SCFA和神經遞質的分析,如ZMB1中SCFA和神經遞質的分析。ZMB1是一種培養各種微生物(雙歧桿菌,擬桿菌,鏈球菌,乳酸桿菌,乳球菌,梭狀芽胞桿菌等)的培養基,并適用于LC-MS/MS的代謝組學分析。

圖3. 部分代謝途徑和LC-MS/MS色譜圖
實驗設計
1.?微生物代謝物的產生
細菌可以從供應商處購買(如美國培養收集(ATCC), DSM德國微生物收集)或從臨床環境中獲得。每次實驗應使用分光光度計檢查600nm (OD600nm)處的光密度,并使用40×或60×物鏡在顯微鏡上檢查微生物形態,以監測微生物的生長。微生物應定期進行革蘭氏染色和選擇性培養基培養的污染檢測。建議在厭氧室中培養厭氧菌,兼性厭氧菌可以在好氧或低氧條件下生長(如帶有厭氧氣體生成小袋或蠟燭罐的容器系統中; 兼性厭氧菌表達的特定代謝途徑可能受到其培養的大氣條件的影響。對于厭氧微生物,必須預先還原化學成分明確的培養基以支持其生長。為了使各組之間的微生物代謝物標準化,建議收集無細胞微生物條件培養基,其包含在相同培養基中產生的代謝物,在相同的孵育條件下,在特定的細菌生長階段,通過OD600nm隨時間監測。
2.?微生物選擇,小鼠菌株,定殖驗證和體內研究的樣品收集
單相關克隆小鼠產生需要的GF動物設施和選擇感興趣的細菌是實驗設計的關鍵部分。腸道微生物幾乎都在GF小鼠體內定植。然而,微生物在非天然宿主中的定殖效率可能會有所不同,需要定期檢查微生物的定殖狀態以確保成功定殖,建議從隔離器內的籠子中收集糞便,提取基因組DNA并通過PCR確認所選微生物的存在。糞便微生物可以在選擇性瓊脂上生長,并檢查集落形成單位(CFU),以確認定植和活力。最后,糞便可直接進行16S核糖體RNA測序確認微生物譜。
實驗小鼠品系選擇:成功定殖雄性和雌性成年Swiss-Webster和C57B6/J小鼠并對品種進行優化。選擇小鼠模型時應考慮某些微生物可能無法在不同遺傳背景的小鼠或老年小鼠中定植。本實驗選擇產仔量大,培育能力強的遠交Swiss Webster GF小鼠,近親繁殖的小鼠遺傳變異增加,基因敲除/敲入模型可用于近交系如C57BL/6J。因此,選擇哪種小鼠品系最能解決感興趣的科學問題至關重要。
微生物定殖時間:本研究用牙芽孢桿菌或卵形芽孢桿菌定殖17天的成年無菌小鼠(圖4),建議每組至少4只小鼠進行初步研究,以確定定植水平與神經遞質和SCFA濃度變化的穩健性。
糞便是否凍干:從動物組收集的糞便顆粒重量大致相同,糞便樣本的含水量沒有被去除,因此在分析代謝物之前建議通過凍干去除水分。在腹瀉情況下,從糞便中去除水分可能很重要。但糞便凍干的弊端是樣品基質中揮發性SCFA的潛在損失。因此,僅在糞便重量預計在組間有變化的情況下對糞便進行凍干。
3.?腸道類器官和培養形式的選擇
由腸道干細胞產生的組織來源的類器官可以分化為與它們來源的胃腸道部分相關的所有細胞類型。例如,從結腸中收集的活檢或組織將包含干細胞、腸內分泌細胞、腸細胞和杯狀細胞。從小腸(十二指腸、空腸或回腸)收集的活檢或組織將包含干細胞、腸內分泌細胞、腸細胞、杯狀細胞、潘氏細胞和簇狀細胞。使用類器官系統的優勢在于保留了其片段的特異性,并且片段在細胞類型、轉運體、粘蛋白分泌、激素分泌和功能方面存在差異。類器官可以來自于各種動物(老鼠、豬、牛、馬等)和人類。綜上該系統提供了比較多個物種、在小鼠和人類之間進行直接比較的能力,腸道類器官也可以由具有特定疾病表型的個體產生,因此腸道類器官有多種應用優勢。
小鼠和人腸道類器官可以在3D或2D中培養,3D形式是最容易培養腸道類器官的,并且類器官向內的管腔可以微注射微生物或微生物代謝物來模擬腸道環境。該顯微注射平臺已被證明可以在3D類器官模型中創建穩定的厭氧微生物群落。為了避免對顯微注射的要求,可以在傳代后將微生物添加到類器官培養中。傳代會破壞類器官結構,當類器官重組時,微生物被困在管腔內。然而很難控制每個類器官所接收到的微生物負荷相同。微生物或代謝物也可以添加到3D類器官的外側但可能不會產生生物學上相關的信號級聯。類器官可以在基質外培養,類器官固有地逆轉其結構,暴露在頂端表面。在這種情況下,微生物或微生物代謝物可以直接添加到培養基中,并與頂膜相互作用,這種“由內而外”的方法非常適合于研究兼性厭氧菌和微生物代謝物。
4.?類器官研究優勢
大多數使用小鼠檢測腸腦軸的研究都使用具有完整腸道菌群的SPF小鼠。然而,腸道菌群的復雜性使這些研究難以解釋。本研究基于LC-MS/MS分析用單一微生物物種定植的已知菌動物模型中的腸道和腦神經遞質及SCFA,能夠解決特定微生物對腸道和大腦的影響問題。
涉及微生物-宿主互作的研究隨著類器官培養的進步正逐步擴大。類器官,又稱類腸或類結腸,來源于供體腸道組織,與傳統的癌癥來源或永生化細胞系相比,具有幾個關鍵優勢:(1)保留區段特異性;(2)所有腸細胞類型的表達;(3)產生腸粘液層;(4)干細胞的維持;(5)激素分泌。使用類器官模型可以剖析微生物和宿主上皮之間的信號傳導如關注上皮腸內分泌激素。本方案的體外技術可用于原代類器官(從組織部位分離),多能干細胞或胚胎干細胞的類器官及其生成的多種組織類型如胃腸道和大腦類器官,類器官還可以從健康個體或特定患者群體產生,適合解決與微生物-宿主互作相關的研究問題。
靶向代謝組學方法為解析共生微生物與宿主之間復雜的雙向相互作用的提供了重要工具,使微生物代謝物,類器官和已知菌小鼠,研究人員可以特異性地識別體內外微生物信號并將它們與宿主內的變化聯系起來,可用于開發設計微生物混合物或新一代益生菌。
5.?具體實驗流程
Step1. 在ZMB1培養基中培養厭氧菌,收集細菌代謝產物
Step2. 準備供定植的細菌或糞便
Step3. 腸類器官顯微注射
Step4. 無菌小鼠準備
Step5. 腦組織分離和代謝物提取
Step6. 腸道內容物收集和代謝物提取
Step7. 糞便樣品代謝物提取
Step8. LC-MS/MS分析制備的生物樣品

圖4. 體外培養基和體內糞便樣本中SCFAs的絕對濃度
腸-腦軸研究熱點促進了分析微生物和宿主來源定量分析平臺的發展,對體外(類器官)和體內小鼠模型系統中代謝物的綜合評估策略:階段1-微生物在確定的培養基中生長;階段2-腸道類器官顯微注射;階段3-動物模型的生成,包括無菌(無微生物)、無特定病原體(完整腸道微生物群)和無特定病原體再常規化(無菌小鼠與來自無特定病原體小鼠的完整腸道微生物群相關),及牙雙歧桿菌和卵形擬桿菌單相關小鼠(無菌小鼠定植單一腸道微生物)。建立了液相色譜-串聯質譜的代謝組學方法用于分析這些樣品中微生物衍生的短鏈脂肪酸和神經遞質。約4-5周即可完成該方案中細菌培養、類器官培養和體內樣本三種實驗模型、菌群衍生代謝物定量、數據下機和歸一化、統計分析等。
繪譜幫你測
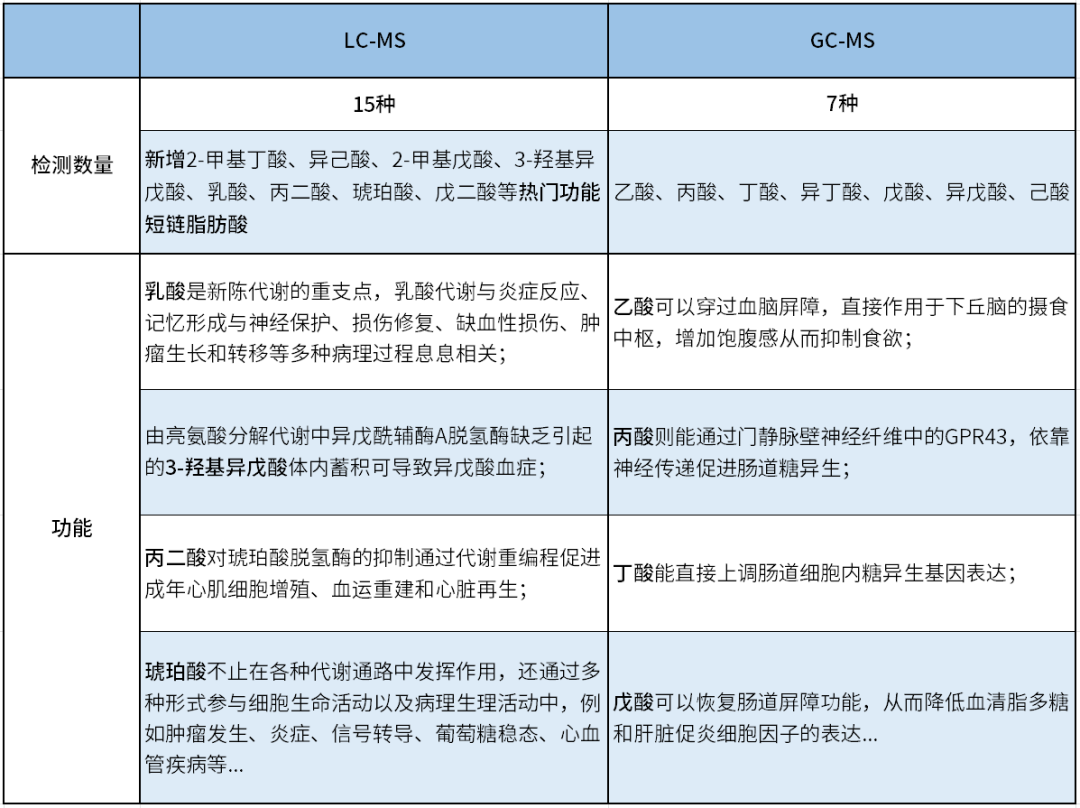
SCFAs是最重要的宿主-微生物代謝相互作用的途徑,在不同組織中濃度差異較大,給檢測帶來一定的困難。麥特繪譜聯合代謝組學研究常用的LC-MS和GC-MS兩大技術平臺,配合使用衍生化、同位素內標等方法定量絕對濃度,精準適配多種樣本類型中SCFAs的檢測。
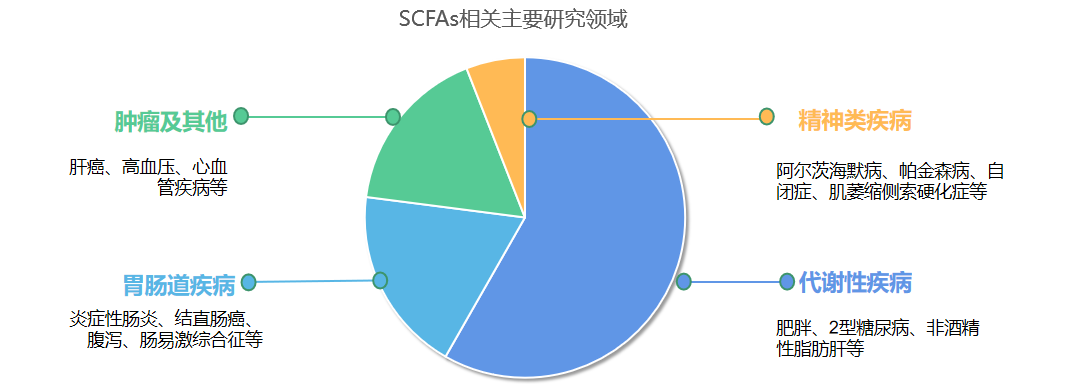
備注:檢索各領域文獻數量占比
參考文獻
Horvath Thomas D,Haidacher Sigmund J,Engevik Melinda A,?et al. Interrogation of the mammalian gut-brain axis using LC-MS/MS-based targeted metabolomics with in vitro bacterial and organoid cultures and in vivo gnotobiotic mouse models.?Nat Protoc. 2023
請掃描二維碼閱讀原文

往期回顧
1. Nature子刊 | 短鏈脂肪酸在微生物-腸-腦通訊中的作用(綜述)
4. Nature Metabolism | 膽汁酸新功能--通過腸腦軸影響食欲

麥特繪譜生物科技(上海)有限公司(Metabo-Profile)匯聚了從事代謝組學和轉化醫學研究近二十年的海內外專家團隊,專注于精準醫學和健康領域的高端代謝組學技術服務,是一家集科技服務、健康檢測及產品研發于一體的國家級高新技術企業、上海市“專精特新”企業,已成為全球代謝組學研究者的優選合作伙伴。公司擁有自建1500+功能性小分子代謝物數據庫JiaLibTM、國際領先的代謝組學分析技術平臺和全自動化TMBQ定量數據處理軟件、代謝組學數據在線分析平臺iMAP。麥特繪譜已為數百家三甲醫院、科研院所和企業提供高端代謝組學一站式整體解決方案,協助客戶與合作伙伴發表SCI文章300+篇,累計影響因子3000+,包括Science, Nature, Cell Metabolism, Immunity, Gut, Signal Transduction and Targeted Therapy, Science Translational Medicine等頂級期刊。

關注了解更多

掃碼關注“麥特繪譜”公眾號

掃碼關注“麥特繪譜”視頻號

掃碼關注“麥特繪譜”B站賬號

掃碼關注“麥特繪譜”知乎號

分享

點贊

在看
-
儀器推薦

-
儀器推薦

-
儀器推薦
 詢底價 Tel:400-6699-117 轉 6306
詢底價 Tel:400-6699-117 轉 6306 -
儀器推薦













