首個治療Alagille綜合征(ALGS),罕見肝病新藥!
Livmarli是一種口服頂端鈉依賴性回腸膽汁酸轉運體(ASBT)抑制劑,導致更多膽汁酸從糞便中排除,減少膽汁酸介導的肝損傷和并發癥。
Alagille綜合征(ALGS)
Mirum Pharma是一家致力于開發創新療法治療罕見肝臟疾病的生物制藥公司。近日,該公司宣布,美國食品和藥物管理局(FDA)已批準Livmarli(maralixibat)口服液,該藥每日口服一次,用于治療年齡≥1歲的Alagille綜合征(ALGS)患者的膽汁淤積性瘙癢。ALGS是一種罕見的遺傳性肝臟疾病,在美國影響2000-2500名兒童。
ALGS由膽管異常引起,可導致進行性肝病。膽管異常或狹窄會導致膽汁淤積,膽汁酸在肝臟中積聚,從而導致炎癥和肝損傷,并阻止肝臟正常工作。ALGS的膽汁淤積與瘙癢相關。瘙癢是與ALGS相關的最常見和最嚴重的癥狀之一,也是ALGS患者進行肝移植的最常見指征之一。
值得一提的是,Livmarli是第一個也是唯一一個被批準用于治療ALGS膽汁淤積性瘙癢的藥物,將為ALGS治療模式帶來一個有意義的轉變。Livmarli通過優先審查程序獲得批準。此前,FDA已授予Livmarli治療ALGS的罕見兒科疾病資格(RPDD)和突破性藥物資格(BTD)。
在批準Livmarli的同時,FDA還頒發給Mirum公司一張罕見兒科疾病優先審查憑證(PRV),以獎勵該公司在罕見病新藥研發方面做出的突出貢獻。這張PRV可以兌換以獲得任何后續新藥申請的優先審查,并且可以出售或轉讓。
Livmarli口服液的活性藥物成分為maralixibat,這是一種口服給藥、具有最小化吸收的回腸膽汁酸轉運體(IBAT)抑制劑。ALGS是一種罕見的肝臟疾病,尚無公認的治療方法,因此存在著重大而緊迫的未滿足醫療需求。Livmarli的批準上市,將為這一毀滅性的疾病帶來有史以來第一個藥物治療選擇,將提供一個有意義的治療方案,最終將減少肝移植的需求。
FDA批準Livmarli,基于關鍵ICONIC研究以及來自支持性研究的5年數據,這些數據共同組成了Livmarli治療86例ALGS患者的強有力證據體。來自ICONIC研究的數據顯示:接受Livmarli治療后,患者瘙癢在統計學上顯著減少(p<0.0001)、其他膽汁淤積性肝病標志物得到改善。
Mirum總裁兼首席執行官Chris Peetz表示:“今天對于ALGS社區來說是一個偉大的日子,FDA批準了一個急需的新治療方案,以解決該疾病最令人虛弱的影響之一。我們感謝推進這項研究并參與Livmarli臨床研究的患者、家屬和醫療專業人員。今天也是Mirum里程碑式的一天,因為我們在開發治療罕見肝病的潛在改變生命的藥物方面邁出了一步。”
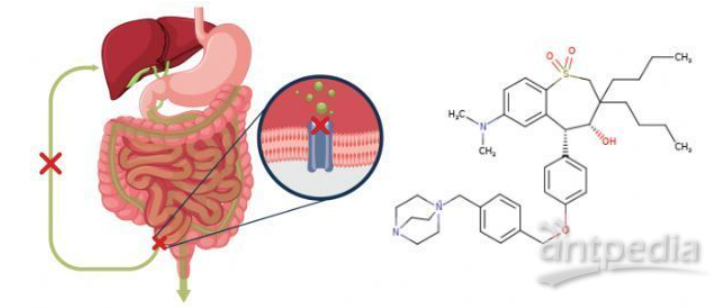
maralixibat作用機制及化學結構式
maralixibat是一種新型的、最小化吸收的、口服回腸膽汁酸轉運體(IBAT)抑制劑,正在對幾種罕見的膽汁淤積性肝病進行評估。maralixibat可抑制頂端鈉依賴性膽汁酸轉運體(ASBT),導致更多膽汁酸在糞便中排出,導致系統性膽汁酸水平降低,從而潛在地減少膽汁酸介導的肝損傷及相關影響和并發癥。
Alagille綜合征(ALGS)是一種罕見的遺傳性疾病,由膽管異常(狹窄、畸形、數量減少)引起,導致肝臟內膽汁積聚,最終發展為肝臟疾病。據估計,ALGS的發病率為每30000人中就有一例。在ALGS患者中,多個器官系統可能會受到突變的影響,包括肝臟、心臟、腎臟和中樞神經系統。
膽汁酸的積累妨礙了肝臟正常工作,以排除血液中的廢物,根據最近的報道,60%-75%的ALGS患者在成年前接受了肝移植。ALGS肝損傷引起的體征和癥狀可能包括黃疸(皮膚變黃)、黃瘤(使皮膚下膽固醇沉積變形)和瘙癢。ALGS患者所經歷的瘙癢是所有慢性肝病中最嚴重的,并且在大多數受影響的兒童中在3歲時出現。
除了ALGS之外,maralixibat也正處于后期臨床開發,用于治療其他罕見膽汁淤積性肝病,包括進行性家族性肝內膽汁淤積癥(PFIC)和膽道閉鎖。之前,FDA也授予了maralixibat治療這2種疾病的突破性療法認定(BTD)和孤兒藥資格(ODD)。
-
焦點事件

-
項目成果

-
產品技術

-
科技前沿
-
項目成果