精準醫療再升級!新技術助質譜流式細胞術靈敏度飆升30倍
質譜細胞術極大地提升了在單細胞水平同時測量多種蛋白標志物的能力,使得對細胞異質性和復雜行為進行深入描述成為可能。然而,其相對較低的靈敏度一直是一個主要限制因素,需要每個表位數百個金屬標記抗體才能達到檢測閾值。這限制了對在健康和疾病中發揮關鍵作用的低豐度蛋白的分析,包括許多轉錄因子、表面受體和磷酸化位點。
在《Nature Biotechnology》雜志2024年7月29日發表的一項突破性研究中,研究人員開發了一種名為循環擴增放大(ACE)的新信號放大技術,以解決質譜細胞術中的靈敏度問題。通過結合DNA連接與光交聯方法,ACE實現了對蛋白表位超過30倍的信號放大,同時保持了特異性。
材料與方法
ACE方法利用熱循環在金屬結合探針的重復雜交位點上生成,從而顯著增加每個抗體關聯的金屬離子數量。
ACE方法在懸浮質譜流式細胞術中的關鍵步驟包括:
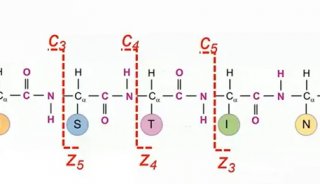
1.抗體-寡核苷酸偶聯:靶向抗體通過共價鍵連接到短DNA引物序列上(總長11個堿基,其中9個為可變區域)。2.細胞染色:將偶聯的抗體應用于細胞懸液,進行表面或細胞內的標記。3.引物延伸:引入與引物互補的延伸寡核苷酸。在22°C條件下,由Bst聚合酶介導引物延伸。4.熱循環:溫度升至58°C以解鏈引物-延伸雜交體,暴露出延伸引物。此循環重復(通常為100到500次),在每個抗體結合位點生成數百次重復序列。5.探針雜交:金屬螯合DTPA聚合物與互補寡核苷酸雜交,雜交到延伸引物上。6.光交聯:通過短暫的(1秒)紫外線照射,激活探針中的CNVK交聯劑,將其共價連接到雜交的DNA鏈上。7.質譜流式細胞術分析:樣本經標準霧化和分析。

對于成像質譜流式細胞術應用,該方法經過調整適用于組織切片,并在激光消融和質譜成像之前在載玻片上進行擴增。
雖然主要焦點在質譜流式細胞術上,但常規流式細胞術在優化和驗證ACE方法中發揮了關鍵作用:
1.信號穩定性評估:使用熒光標記的探針評估模擬質譜流式細胞術樣品引入條件下的加熱信號損失。流式細胞術分析顯示,在55°C加熱1分鐘后,未經交聯的樣品信號減少超過90%。2.交聯效果驗證:通過比較紫外線照射樣品與未照射樣品在加熱處理后的熒光信號保留情況,驗證了光交聯步驟,使用流式細胞術進行分析。3.擴增特異性:使用GFP轉染的HEK293T細胞創建表達梯度。流式細胞術對比了ACE擴增的抗GFP信號與傳統熒光抗體標記及免疫SABER擴增,結果表明ACE的信噪比顯著更高(比二抗高3.6倍,比免疫SABER高27倍)。4.動態范圍評估:通過流式細胞術分析GFP表達梯度,確認ACE擴增在廣泛的靶蛋白豐度范圍內保持了信號的線性。
結果
1、擴增效率和特異性
研究團隊利用GFP轉染的HEK293T細胞展示了ACE能夠在500次熱循環后實現高達13倍的信號擴增,相較于未擴增的對照組,信噪比提高了6倍。值得注意的是,擴增過程在整個GFP表達水平范圍內保持了線性,確保了細胞間定量關系的完整性。
2、細胞轉化過程中的多重蛋白定量
研究人員應用32參數的ACE組合研究了小鼠Py2T細胞在上皮-間質轉化(EMT)及相對較少研究的間質-上皮轉化(MET)過程中的分子重編程。分析表明,Zeb1與Cyclin B1的表達比例可以作為MET過程中細胞的標志物,這一發現若無ACE的高敏感性將難以揭示。
3、T細胞受體信號傳導動力學
研究團隊使用ACE同時擴增了人類Jurkat T細胞和原代人類CD4+ T細胞中的30個T細胞受體(TCR)信號傳導標志物,從而實現了對TCR信號網絡在1小時刺激時間內的全面分析。此方法揭示了信號傳導級聯中的細微動力學變化,并鑒定出一種可能由組織損傷誘導的免疫抑制性T細胞表型,這在對患者術后液體(POF)聯合刺激的響應中得以體現。
4、高參數組織成像
通過將ACE與成像質譜細胞術(IMC)相結合,研究團隊分析了人類腎臟組織的結構組織和表型異質性。該方法成功地再現了腎皮質中的六個主要區域,并揭示了多囊腎病中干細胞標志物Nestin的異質性表達。
為了說明ACE在揭示細微細胞表型方面的能力,請參見下表,總結了T細胞信號傳導實驗中的關鍵發現:

該表格展示了ACE增強的敏感性如何揭示信號傳導中的細微差別和細胞亞群,這些信息是傳統質譜細胞術方法所無法捕捉的。
研究人員還展示了其擴增序列的正交性,平均通道間串擾僅為1.07%。這種高度的特異性結合顯著的信號擴增,使ACE成為深度表型分析稀有細胞群體和定量低豐度蛋白質的強大工具。
在組織成像領域,ACE在保持空間分辨率的同時實現信號擴增的能力尤為珍貴。增強的敏感性使得能夠檢測到不同腎臟區域蛋白質表達中的細微變化,為多囊腎病中的細胞組成和潛在病理變化提供了新的見解。
總體而言,本研究將ACE呈現為一種增強質譜細胞術敏感性的多功能且強大的方法,無論是在懸浮應用還是成像應用中。通過在單細胞水平上實現低豐度蛋白質的可靠定量,ACE為理解復雜細胞行為、疾病機制和組織結構開辟了新途徑。該方法與現有質譜細胞術工作流程的兼容性及其已展示的多重檢測能力,使其成為各類生物醫學領域研究人員的有力工具。
正如任何新技術一樣,在不同樣本類型和實驗背景下進一步驗證是至關重要的。此外,在設計研究時,還需要仔細考慮擴增過程對樣本制備時間和成本的影響。然而,ACE在揭示以前無法觀測的細胞現象方面的潛力,使其成為單細胞分析領域的重要進展。
-
精英視角

-
企業風采
-
精英視角

-
企業風采

-
企業風采

-
精英視角

-
焦點事件