藥典委:9101 分析方法驗證指導原則標準草案的公示
近日,國家藥典委員會宣布,為提升藥品質量控制標準,確保分析方法的科學性、合理性和適用性,對現行《中國藥典》中的9101分析方法驗證指導原則進行修訂,并對外發布修訂草案的公示。公示期自即日起至2024年8月9日,為期90天,以廣泛征求社會各界的意見和建議。

本次修訂工作由江蘇省食品藥品監督檢驗研究院牽頭,主要起草人為王玉、曹玲和李睿。修訂內容主要依據國際藥品監管機構協調會(ICH)的Q2(R2)、Q14等指導原則,以及各國藥典的相關章節,并結合國內實際情況進行。
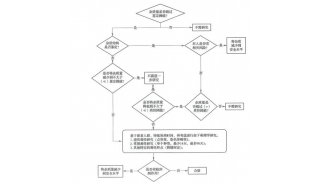
修訂草案的核心內容包括:
文本結構和框架的調整:對原指導原則的結構和框架進行了優化,使之更加清晰和易于理解。
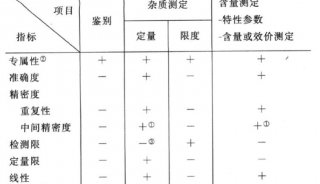
驗證參數的重新分類:對分析方法驗證中涉及的參數進行了重新分類和歸屬,以便于更準確地指導實際操作。
多變量方法的考慮:增加了對多變量分析方法的考慮,以適應現代分析技術的發展。
專屬性、準確度、精密度驗證內容的完善:對專屬性、準確度和精密度的驗證內容進行了補充和完善,提出了準確度和精密度聯合驗證的新概念。
系統適用性試驗:明確了系統適用性試驗在分析方法驗證中的重要性,并提供了相應的指導。
統計學考慮:強調了統計學方法在評價分析方法驗證結果中的應用,以及對風險評估的重要性。
以下是通知原文:
關于9101 分析方法驗證指導原則標準草案的公示
我委擬修訂《中國藥典》9101分析方法驗證指導原則。為確保標準的科學性、合理性和適用性,現將擬修訂的9101分析方法驗證指導原則公示征求社會各界意見(詳見附件)。公示期自發布之日起三個月。請認真研核,若有異議,請及時在線反饋,并附相關說明、實驗數據和聯系方式。來函需打印后加蓋公章,個人來函需打印后本人簽名,并郵寄至我委通訊地址。
公示期滿未回復意見即視為對公示標準草案無異議。
聯系人:徐昕怡、朱冉
電話:010-67079522、67079581
通信地址:北京市東城區法華南里11號樓 國家藥典委員會辦公室
郵編:100061

附件
附件 9101分析方法驗證指導原則草案公示稿(第一次).pdf
-
標準

-
政策法規

-
焦點事件

-
焦點事件

-
標準

-
政策法規

-
焦點事件

-
標準
-
標準