企業簡介
旭月(北京)科技有限公司(http://xuyue.net),是2005年創立于中關村科技園區的國家高新技術企業。創始人許越先生,曾服務于美國航空航天局NASA,是現代“非損傷微測技術(NMT)”奠基人,動態分離子組學(imOmics)創始人,NMT產業化倡導者,美國揚格公司(http://youngerusa.com)現任總裁。
聯系方式
電話:010-82622628
公司地址:北京市海淀區蘇州街49-3號盈智大廈601
郵 編:100080......
IJMS聯盟澳洲專家:HKT1;5通過調節植物鈉鉀鈣離子穩態響應鹽脅迫
上一篇 /
下一篇 2021-02-03 14:07:03
NMT作為生命科學底層核心技術,是建立活體創新科研平臺的必備技術。2005年~2020年,NMT已扎根中國15年。2020年,中國NMT銷往瑞士蘇黎世大學,正式打開歐洲市場。

基本信息
主題:HKT1;5通過調節植物鈉鉀鈣離子穩態響應鹽脅迫
期刊:International Journal of Molecular Sciences
影響因子:4.556
研究使用平臺:NMT植物耐鹽創新平臺
標題:Changes in Expression Level of OsHKT1;5 Alters Activity of Membrane Transporters Involved in K+and Ca2+ Acquisition and Homeostasis in Salinized Rice Roots
作者:塔斯馬尼亞大學Sergey Shabala,Mohammad Alnayef
檢測離子/分子指標
K+、Na+、Ca2+
檢測樣品
水稻根伸長區(距離根尖1.2 mm根表上的點)、成熟區(距離根尖15 mm根表上的點)、根木質部薄壁細胞
在水稻中,OsHKT1;5基因已被報道是耐鹽性的關鍵決定因素。該基因由SKC1基因座攜帶,其作用歸因于Na+從木質部卸載。然而,以往的研究并未提供直接證據。此外,SKC1在向地上部裝載(loading)和運送K+方面的報告功能還有待解釋。本工作采用非損傷微測技術比較了野生型(WT)和NIL(SKC1)植物根木質部薄壁細胞吸收Na+的動力學。數據顯示,在野生型植物中觀察到Na+重吸收,但在NIL(SKC1)植物中未觀察到,因此質疑HKT1;5作為直接從木質部中去除Na+的轉運蛋白的功能。相反,HKT1;5表達水平的改變改變了水稻表皮和中柱中參與K+和Ca2+吸收和穩態的膜轉運蛋白的活性,從而解釋了觀察到的表型。本研究得出的結論是,HKT1;5在植物耐鹽堿性中的作用不能僅僅歸因于降低木質部汁液中Na+的濃度,而是引發了其他轉運蛋白在脅迫條件下參與維持植物離子體內穩態和信號傳導的活動的復雜反饋調節。
離子/分子流實驗處理
5日齡水稻水培幼苗80 mM NaCl實時處理
當向WT植株根施加80 mM NaCl(模擬木質部汁液Na+濃度的增加)時,可測到強烈而持續的凈Na+吸收(圖1A, C)。從功能上講,這種吸收與根木質部對Na+的重吸收是一致的(無論是通過HKT1;5還是通過一些其他運輸系統)。然而,在NIL(SKC1)中,沒有這種吸收。相反,敲低(Knockdown, KD)株系表現出木質部薄壁細胞對Na+的凈吸收甚至略高于WT(圖1A,C)。這些結果與本文全株Na+含量數據結果一致。
然后,研究測定了NaCl對K+在根星狀組織(stellar tissue)質膜上傳輸的影響(圖1B,D)。在所有3個株系中,NaCl加入到溶液中,導致了瞬時的凈K+外排。從功能上看,在植物體內,這相當于NaCl誘導的K+向蒸騰流中的裝載。K+外排速率的大小為NIL(SKC1)>WT>KD,與本研究在NIL(SKC1)株系地上部積累較高的K+結果一致。

圖1. 80 mM NaCl實時處理對木質部薄壁細胞凈Na+和K+流速的影響。(A, B) NIL (SKC1)、WT和Oshkt1;5 (4A-02764)敲低株系(KD)的實時Na+(A)和K+ (B)流速。(C, D)分別為脅迫后30 min內Na+和K+流速的平均值。正值表示吸收,負值表示外排。
本文想探究HKT1;5表達的改變是否會影響根表皮中膜運輸體的功能活性。為了做到這一點,研究首先比較了根表皮Na+在所有三個株系吸收的模式(圖2A, B)。這種吸收能力在NIL(SKC1)中最強,其次是WT,然后是KD株系,說明HKT1;5在根星狀組織中表達水平的變化強烈影響了根表皮的Na+吸收能力。進一步,NaCl誘導的表皮根細胞K+外排大小依次為:NIL(SKC1)>WT> KD(圖2C-E)。在兩個根區都觀察到這種模式。與成熟區(MZ)相比,伸長區(EZ)的K+外排要強得多(約為MZ的6倍)。

圖2. 80 mM NaCl實時處理下根表皮細胞凈K+、Na+流速的變化情況。(A)從WT伸長區測得的實時Na+流速。(B) NIL (SKC1)、WT和Oshkt1;5 (4A-0.2764)(KD)株系在伸長區測得的Na+吸收峰值。(C)從WT伸長區和成熟區測得的實時K+流速。(D, E )分別為NIL (SKC1)、WT和Oshkt1;5株系伸長區和成熟根區脅迫后30 min內的K+流速。正值表示吸收,負值表示外排。
水稻HKT1;5株系在實時NaCl處理下,引起Ca2+瞬時外排(圖3),可能是由于細胞壁的Donnan交換引起的。然而,這種反應在EZ中更為強烈,在瞬時反應結束時,凈Ca2+流速值仍然為負值,表明一些活躍的Ca2+外排系統的參與。這種凈Ca2+外排的順序發生了變化,NIL(SKC1)<WT<KD,這表明在NIL(SKC1)中HKT1;5的過表達破壞了其中一個Ca2+外排系統(Ca2-ATPase或CAX交換器)的運行。
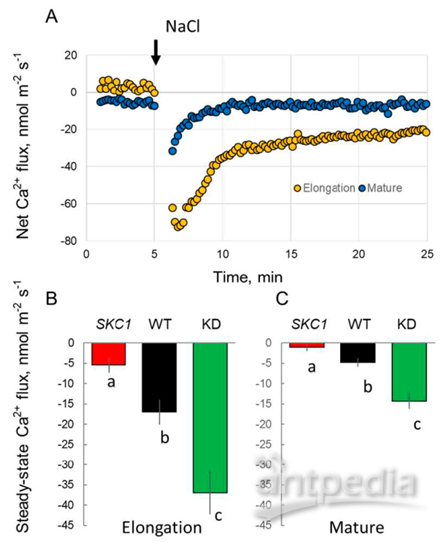
圖3. 80 mM NaCl實時處理下根表皮細胞凈Ca2+流速的變化情況。(A)從WT植物的伸長區和成熟區測得的實時Ca2+流速;(B,C)分別從NIL(SKC1)、WT和Oshkt1;5植株的伸長區和成熟根區測得脅迫后30 min內的平均Ca2+流速。正值表示吸收,負值表示外排。
其他實驗結果
NIL(SKC1)植物根伸長區和成熟區HKT1;5的表達均顯著高于WT,并且HKT1;5的轉錄水平隨著鹽分的升高而顯著上調。
鹽脅迫下,NIL(SKC1)表現出更敏感的表型,與WT相比,葉子萎蔫和壞死的比例更大,地上部和根干重顯著降低。
NIL(SKC1)植株在鹽脅迫下積累了很多的K+和Na+。
NIL(SKC1)植株在對照和鹽脅迫下RBOH轉錄本的表達均有所降低,但在伸長區RBOHD的表達要高得多。同時,與WT相比,NIL(SKC1)植株GORK表達降低,RBOHD表達增加。同時,兩個根區的SOS1轉錄水平都較低。
導入論壇收藏
分享給好友
推薦到圈子
管理
舉報
TAG:





