數圖詳解|如何遵循QbD進行凍干工藝設計與優化?

隨著具有潛在療效的生物分子數量不斷增加,對了解這些生物分子結構復雜性和穩定性的需求也在與日俱增。相對于其它干燥技術,冷凍干燥依然是最受歡迎的穩定的技術,原因很簡單:它是一個低溫的過程,可以用于處理生物溶液而使其免遭破壞,提高藥物制劑的穩定性和貨架期。然而,冷凍干燥又是一個復雜的過程,如果設計不當,容易在處理過程與儲存過程中產生不穩定性。

圖1:QbD質量源于設計理念
基于PAT ICH Q8/Q9/Q10準則對QbD的規范法案中可以看出,產品與過程的性能特征都需要經過科學設計以滿足特定目標,而不是憑經驗從實驗中推導。
一、為什么要遵循QbD進行冷凍干燥?
法規要求
ICH指南Q8、Q9、Q10要求。FDA及GMP近年來也強烈建議遵循QbD理念,以最大程度上保證產品質量,減少和控制風險。
美國FDA在2004年"Pharmaceutical cGMP for 21st-A Risk Based Approach" 報告中正式提出了QbD的概念,并且被人用藥品注冊規定國際協調會議(ICH)納入質量體系當中。在ICH質量體系框圖中,明確提出了要求達到理想的質量控制狀態,必須從藥物研發以及質量源于設計、質量風險管理以及藥物質量體系三方面入手,即Q8,Q9和Q10 的結合;其中Q8 中明確說明質量不是通過檢驗注入到產品中,而是通過設計賦予的。
產品注冊
- FDA/EMEA/MHRA認為基于實證或經驗的方法不再足夠好;
- 可重復性與穩健性不一樣;
- 你需要知道邊界值在哪里,你離失敗的邊緣有多近。
生產效益
用科學的原理來支撐你的凍干工藝,從而得到好的工藝和產品。
經濟效益
您可以將生產經濟融入到你的工藝設計,提高生產放大和技術轉移的信心和工藝穩健性。
二、QbD相關術語——凍干過程關鍵參數
相關術語
| 關鍵質量屬性(CQAs) |
目標產品質量概況((Q)TPP) | |
關鍵工藝參數(CPPs) | |
設計空間 ( DS ) | |
可接受空間( AS ) | |
操作空間( OS ) |
這就需要基于目標產品的情況(Q)TPP和CQAs得出CPPs,得到對目標過程的定義,再結合相關技術去建立設計空間和控制整個過程,按照既定的目標設計出合格的產品。
示例:凍干產品關鍵質量屬性與目標產品質量

>凍干關鍵工藝參數(CPPs)
關鍵過程參數 CPsP(表2)

關鍵產品參數 CPtP(表3)

其他
● 小瓶/容器尺寸、傳熱系數(Kv);
● 灌裝深度、濃度;
● 輻射熱 / 冷卻。
>凍干關鍵工藝參數與產品質量的關系:

三、如何遵循QbD進行凍干工藝設計,在凍干過程中降低風險?
>設備:深入了解你的冷凍干燥機
- 仔細閱讀制造商的規格 |
- IQ / OQ測試–確認機器是否合格 |
- 阻塞流研究,了解設備的極限性能(最大升華速率)(圖2) |

圖2:設備能力曲線(藍色)
設備極限性能測試方法: (1) 最小可控壓力法; (2) 氣流受阻點方法; (兩種方法比較見圖3) |
設備極限性能測試技術: LyoFlux(TDLAS)/MTM |

圖3:最小可控壓力法和氣流受阻點方法比較
>配方:理解配方關鍵溫度
*冷凍干燥顯微鏡

圖4:凍干顯微鏡及塌陷溫度測定
- 定義配方塌陷溫度和共晶點/共熔點;
- 微塌陷? 退火的影響?表面結殼?
*差示熱分析/阻抗

圖5:差示熱分析/阻抗
DTA或DSC:
測定顯著的吸熱和放熱事件,如:結晶,熔化,玻璃化轉變,吸熱松弛等。
阻抗分析:
熱技術可能無法發現分子遷移率的變化,阻抗分析能在更復雜的非晶態產品中提供玻璃化化過渡等事件。
>工藝動態
了解不斷變化的平衡過程中的風險,用完善且先進的PAT工具,對凍干過程中所有的關鍵工藝參數(關鍵過程參數CPsP和關鍵產品參數CPtP進行實時在線的監測和控制),建立設計空間,確定邊界值及合理且優化的工藝空間。
理解變化的風險(圖6)

圖6:一次干燥
關鍵工藝參數實時在線監測與控制,深入理解凍干過程(圖7)

圖7:凍干過程關鍵工藝參數實時在線監測與控制
凍干工藝設計空間DS(圖8)
建立凍干工藝設計空間DS,確定邊界值、可接受空間、操作和優化空間。
詳細步驟如下:


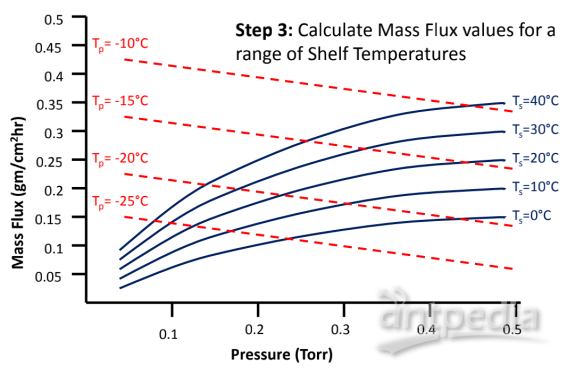
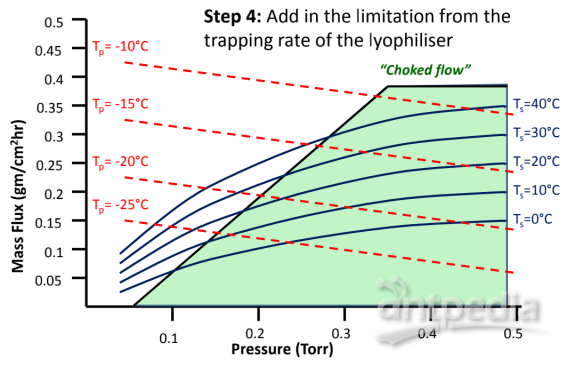




圖8:如何建立凍干工藝設計空間
>基于QbD理念的凍干工藝設計整體流程

圖9:基于QbD理念的凍干工藝設計整體流程圖
總結
● QbD以預先設定的目標產品質量特性作為研發起點,在了解關鍵物質屬性的基礎上,通過試驗設計,研究產品的關鍵質量屬性,確立關鍵工藝參數。在多影響因素下,建立能滿足產品性能且工藝穩健的設計空間(Design Space)。并根據設計空間,建立質量風險管理,確立質量控制策略和藥品質量體系;
● 實施QbD是將PAT過程分析技術與風險管理綜合應用于藥品工藝開發的過程,它的目的不是消滅生產過程中的偏差,而是建立一種可以在一定范圍內調節偏差來保證產品質量穩定性的生產工藝;
● QbD是cGMP的基本組成部分,是科學的,基于風險的全面主動的藥物開發方法,從產品概念到工業化均精心設計,是對產品屬性、生產工藝與產品性能之間關系的透徹理解;
● 基于QbD理念進行凍干工藝設計和優化,用CQA/QTPP/CPP來識別關鍵和非關鍵階段以及每個階段的相對風險。用“約束理論”識別最大風險點(主干燥),提供最大風險的解決方案,并將其它風險一起控制。對凍干配方、設備和工藝進行深入的理解和控制,最終按照即定的工藝目標設計并生產出合格且優質的產品,并將風險降至最低。這就是QbD所追求的!
-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章
-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章
-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章







