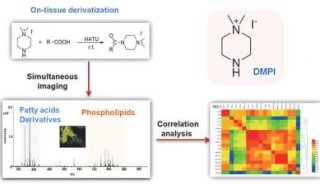
MALDI技術在質譜成像中的應用
一、質譜成像技術簡介
成像質譜(IMS)是一種非常靈敏的分子成像技術,可提供組合的分子信息和空間分辨率。它允許從組織切片、單細胞或其他物質表面直接鑒定和定位化合物分子。成像質譜研究的核心特點是質譜儀的高靈敏度、技術的無標簽性、對肽和蛋白質的成像能力,以及從個體水平(幾百微米)到細胞水平(幾十納米)空間分辨率。成像質譜允許在單個實驗中同時檢測數千個不同分子的圖像。因此,它是一種有效的多組分分子成像技術。科學家們已經開發了許多不同的成像質譜方案和儀器來研究生物內源性化合物,如脂質、肽和蛋白質,以及外源化合物,如聚合物,或者用于研究組織處理藥物的分布。這些研究提供了從亞細胞層次到有機體層次生物過程的詳細情況。

??? 當今,成像質譜主要是用于病理學離體組織研究的技術,并不具備MRI(磁共振成像)或PET(正電子發射斷層攝影)掃描的體內診斷能力。然而,它可以作為體內成像的補充技術來驗證生物分子的分布代謝規律或不同疾病階段藥物的遞送方式。許多研究人員正在探究用這種補充成像方式來解決分子分布的具體問題。這種做法的理由很明顯。沒有其他單一的成像技術能夠以適當的空間分辨率、時間分辨率及生物學狀態提供分子結構和解剖信息的適當組合。與其他分子成像方法相比,如MRI,PET或免疫組織化學(IHC),成像質譜有一個獨特的特征:它可以使化合物分子可視化而又無需標記,這可以實現其他技術所不能實現的對新化合物分布規律的研究。通常,它是在使用影響色差的常規染色劑(例如通常用于組織染色的蘇木精和曙紅(H&E)情況下,可以做化合物分子鑒定的唯一工具。它可以用于常規組織學染色劑不可實現的化合物分子分布規律的研究。這是因為在病理學中使用的常規染色劑只提供一般組織分型,而不識別特定分子,不提供分子修飾及其組合信息等。不能被常見組織染色劑染色的幾種藥物和代謝物如表1所列。

二、質譜成像的解吸和電離技術
IMS需要從被研究物質的表面解離和離子化化合物分子。主要有兩種物理方法:(1)用載能帶電粒子碰撞分析物表面,(2)用來自脈沖相干光源的光子照射表面。
1. 帶電粒子的解吸和電離
帶電粒子主要用于二次離子質譜(SIMS)成像。在這種方法中,分析物表面暴露于高能聚焦的一次離子束下。離子撞擊會導致表面上下分子的級聯碰撞,從而引起表面分子的移動和電離。隨后,碰撞產生的二次離子可以進入質量分析器分析以確定其性質。碰撞能量通常會保持較低,以確保一次離子可以與不同區域表面分子相作用,并且確保已碰撞區域不再進行二次碰撞分析。低于表面層分析碰撞能量的實驗被稱為靜態SIMS實驗。高于該碰撞能量的實驗,被稱為動態SIMS實驗。在動態SIMS實驗過程中,分析物表面會發生持續的變化。在靜態SIMS實驗中,被分析的表面通常在1%以內。
在SIMS實驗過程中,大量的內部能量被轉移到表面分子中。這會導致表層化合物分子產生大量的碎裂。這使得該方法不適合直接研究大分子物質,如肽和蛋白質等。該方法可以較好地觀測待測物表面元素和小分子化合物分布規律。化合物碎裂模式與電子碰撞電離中觀察到的碎裂模式相似。
最常用的一次離子種類是銦和鎵。它們主要應用于半導體表面上的元素和有機雜質研究,以及薄層表面涂層的研究。受益于較大簇離子或分子離子的應用,切片組織等生物表面也可以被分析。較大的一次離子有Aun+、Binm+、C60+等。這些離子可以使完整次級分子離子的產率更高,并且減少了分子離子碎裂。此外,這些離子的應用還可以顯著降低對表面下層分子的破壞,從而增加三維成像實驗成功的可能性。
所有的SIMS實驗與以上所述的離子光束均需要保持真空環境,否則初級離子會因為平均自由程太短而不能到達分析物表面。解吸電噴霧電離(DESI)是大氣壓下的解吸和電離技術。它會產生電噴霧液滴,然后在大氣條件下被傳送到待分析物表面。溶劑液滴吸附到表面分子上,從而產生與常規電噴霧質譜電離相似的二次離子。這種方式可以產生帶多電荷的準分子離子。據報道,該方法適用于多種待測物的表面分析,包括藥物片劑、血跡和組織切片等。研究顯示,DESI技術用于組織成像可以可視化觀察腦和腫瘤組織切片中的磷脂和脂質。
2. 光子解吸、電離
2.1 LDI和MALDI
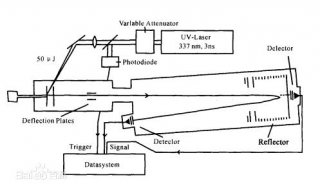
能夠從表面解離和電離分子的第二種方法是光子與表面分子產生相互作用。通常,脈沖激光束聚焦在分析物表面上。由表面層吸收的光子能量會導致表面材料的爆炸性去除或消融。
當使用紅外(IR)或可見光時,光子能量主要轉化為表面振轉能量。在紫外線或真空紫外線(VUV)光下,光子能量增加可以引發大量的電子激發。如果積累在待分析化合物分子中的內部能量足以引起直接電離,該過程被稱為激光解吸和電離(LDI),如圖1(a)所示。在激光解吸過程中積累的內部能量通常比較高,表面分子可以發生大量的碎裂。此外,有機化合物的低電離效率使得該技術不太適合于大分子質譜分析。這些情況下,可以應用激光解吸后電離(LDPI)策略來電離解吸過程中產生的中性粒子(圖1(b))。后電離策略可以在真空條件下通過UV或VUV波長范圍內的二次能量激光束照射實現。最近研究表明,激光解吸可以有效地與ESI離子源聯用,從而在大氣壓力條件下可以進行激光燒蝕電噴霧電離(LAESI)(圖1(c))。這種組合增加了可以用激光解吸策略分析的化合物類別,并能減少化合物碎裂。當與電感耦合等離子體質譜(ICP-MS)組合時,激光燒蝕可以成功地用于待測品表面元素的定量分析。燒蝕的組分被等離子體源霧化并離子化成構成元素和同位素離子,隨后通過質譜儀進行分析。當與光發射光譜法結合時,使用從ICP發射的光可以獲得更多定量基本信息。
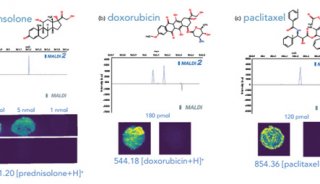
由于存在大量碎裂,直接LDI策略不適用于分子量超過500Da的生物大分子分析。這時可以選擇使用能量調節基質。分析物混合或被涂布在待分析物表面上(參見圖1(d))可以克服這個限制。在20世紀80年代晚期,由Karas和Hillenkamp構想的這種技術被稱為基質輔助激光解吸和電離(MALDI)。它是現代蛋白質組學研究中的關鍵技術,可以應用于生物大分子,如蛋白質和DNA分子的解吸和電離。在復雜待測物表面的MALDI分析中,基質輔助方案有更多的用途。

首先,應用基質后,它可以將復合物樣品中的待測分子重構在基質晶體中間或者表面。這些分析物摻雜基質晶體的形成,可以將待分析物與其他輔助因子如鹽等分離,并可以將大分子分散在基質中。用脈沖激光對晶體表面的后續照射能夠快速地使樣品過熱。這是作為激光能量強吸收體的基體受到電子激發(UV-MALDI)或振動激發(IR-MALDI)作用的直接結果。協同運動的過熱基質與其夾帶的分析物可以被引導到的真空中。這有助于分析物分子氣相化的非破壞性轉變。基質的最后一個目的是通過電荷轉移促進分析物分子的電離。該方法通常會使[M+X]+型的陽離子轉化成完整的準分子離子,其中X表示產生的陽離子的類型。最常見的陽離子是氫、鈉和鉀。為保證分析成功,分析物分子必須與固體基質材料共結晶,并且這些基質應該是過量的。最常用的基質與分子的比例在103:1至105:1的范圍內。根據經驗,研究的分析物的質量越高,完全解吸所需的基質剩余越多。
2.2 MALDI在敞開環境中的應用
近來敞開式解吸策略的發展已經產生了一些進步,該策略也需要使用基質。類似于LAESI方法,其基質、分析物混合物需要在基材上共結晶,這樣可以有更多完整樣品從表面移除。 MALDI離子會受質譜入口和樣品表面之間電場的作用而發生偏轉。從MALDI基質上產生的中性粒子含有大量在真空MALDI實驗中丟失的分析物分子。它們可以被吸附在尚未完全霧化的電噴霧液滴表面。接下來是常規的產生多電荷離子的電噴霧電離過程。該過程又縮寫MALDESI(基質輔助激光解吸電噴霧電離),它可以將MALDI在敞開環境中的優點以及電噴霧電離的靈敏性結合起來。
2.3 MALDI和液相色譜
MALDI技術和液相色譜(LC)分離技術的成功聯用,提高了復雜混合物的分離檢測效率。分析復雜混合物時,MALDI會受到顯著的離子抑制。不同物化性質的化合物分子共存通常會導致一種或幾種組分優先于其他組分離子化。離子抑制效應是許多分析學科量化研究的主要障礙。對MALDI質譜強度差異的解釋本質上是定性的。克服該問題的一個方法是進行色譜分離以降低混合物的復雜性。許多nano-LC-MALDI方法已經實現了將分離時間尺度轉換為空間分布尺度。自動點樣技術可以將一系列二維納升液相洗脫液滴(通常每滴為150納升)沉積到MALDI基質預涂層上。也可以采用其他方法將基質溶液與LC洗脫液混合,并將該混合物液滴有序沉積在干凈的基質靶板上用于質譜分析。
3. SIMS中基質的使用
使用能量調節基質材料的優點并非僅限于光子解吸和電離技術。MALDI質譜技術的成功使MALDI基質在SIMS(二次粒子質譜分析法)樣品制備中的應用成為可能。分析物與MALDI基質(2,5-二羥基苯甲酸/DHB)的共結晶,更加方便了采用基質增強型SIMS(ME-SIMS)方法對質量超過10kDa的大分子離子進行檢測。因此,這種僅基于SIMS電離方法產生完整大分子離子(肽,蛋白質,寡核苷酸)的技術是成功的。有人提出,基質在ME-SIMS中的作用與在MALDI中的作用相似:都是為分析物分子提供了一個嵌套環境,并提供了質子來增強電離。以DHB為基質可以獲得最佳結果,可能解釋是DHB提高了樣品表面區域中分析物的濃度。由于ME-SIMS(與MALDI相比)僅檢測表面50nm之內,所以分析物的定位在樣品制備中至關重要。分析物分子必須存在于晶體的表面,因為在靜態SIMS條件下不能檢測到基質共結晶的較深層次。
三、成像質譜的空間分辨率
IMS的一個關鍵參數是可實現的空間分辨率。空間分辨率決定細胞和組織表面可觀察到的細節。獲得質量分辨率圖像的最常見方法是使用微探針或掃描模式。微探針模式質譜成像通過SIMS掃描樣品上的電離探針束或移動樣品通過MALDI對焦進行。對于每個特定位置,帶電離子束與樣品相互作用,存儲坐標,并獲得位置相關離子產生的質譜數據。以這種方式構建光柵,光柵中的每個點都具有與其相關聯的質譜數據。使用專用軟件,可以從這些數據集中構建質量分辨的離子圖像。微探針成像實驗中最大的可實現空間分辨率由微探針的尺寸決定。在技術上,光柵中每個點的精度是控制分辨率的另一個因素,但是對于SIMS和MALDI成像,通常這不是一個問題。此外,實驗實現的空間分辨率受樣品制備(基質)和靈敏度(信噪比)相關因素的影響。
1. 二次離子質譜(SIMS)和解吸電噴霧電離質譜(DESI)成像質譜的空間分辨率
SIMS使用離子源的大多是由液體金屬離子槍構成。 Ga +和In +主要用于表面元素和小分子分析。使用這些槍可以獲得的空間分辨率由發射器的大小,離子柱中的靜電光學元件和主光束電流決定。后者通常保持較低以防止光束的空間電荷膨脹和分辨率損失。當在低電流下進行調諧時,這兩支槍可以提供50nm的焦點。金屬簇光束Aun+、Bin+以及C60+可以在非常低的光束電流下提供100-200nm的光斑尺寸。低光束電流通常需要更長的實驗時間。因此,為了應用更大的束電流增加分析速度,空間分辨率通常會受到一定損失并減小到大約1μm。 DESI使用指向表面的帶電溶劑液滴噴射流。噴射流與表面的潤濕相互作用中,作用區域大小決定了空間分辨率。研究表明,DESI成像的常規空間分辨率為1mm左右。
2. 激光直接成像(LDI)和基質輔助激光解析電離(MALDI)成像質譜的空間分辨率
聚焦激光束的分辨率是波長決定的,并受阿貝衍射極限的限制。長波長的紅外激光器難以聚焦在50μm以下。商業儀器中的UV激光光斑的物理尺寸限制在約10μm。在商業儀器上,大多數實驗用激光光斑尺寸在50和250μm之間。這個選擇是由靈敏度和完成實驗所需的時間決定的。特殊的共焦目標可以將斑點尺寸減小到1μm,但是使用MALDI的這些小斑點所需的激光閾值通量對于組織中化合物的無損分析是不是太高仍存在實質性的爭論。初步實驗顯示了其從分析物獲取高分辨率圖像的能力。替代方法是使用常規MALDI-ToF儀器的過采樣方法增加空間分辨率。在這種方法中,激光探針點的移動增量小于光點直徑。所有樣品在第一個采樣點完成后,每個采樣增量都會從比激光焦點尺寸小得多的區域采集信息,從而達到增加空間分辨率的目的。這種方法的兩個缺點是有限的質譜串聯可能性和較大的總樣品消耗量。
四、成像質譜儀:發展和改進領域
使用上一節描述的解吸和電離技術,可以在復雜表面產生原子和分子離子。質譜圖像的產生需要對這些產生的離子進行后續質量分析。現代質譜方法提供了一系列質量分析儀器來達到此目的。本文介紹三種類型的質量分析儀器,為生物表面的MALDI或SIMS質譜成像提供獨特的分析能力。
1. 飛行時間成像質譜法
IMS中最常用的質量分析器是飛行時間分析儀。它需要產生脈沖離子,這一要求理想地與MALDI和SIMS要求兼容。所有離子都具有相同的加速電位。相同質荷比的離子將在其解吸過程產生的初始動能之上獲得相同的動能。因此,它們的速度取決于它們的質荷比,并且離子可以通過在無場區域中的漂移而分離。離子檢測是通過多通道板(MCP)類的粒子檢測器實現的。ToF分析提供了非常寬的質量范圍,該范圍僅受大分子物質檢測靈敏度的限制。MALDI-ToF-MS最多可以對數百萬道爾頓的分子進行分析。微秒范圍內的高傳輸效率和總飛行時間,為使用高重復率激光器進行高靈敏度表面檢測提供了可能性。這使得高通量分析成為可能,而高通量分析正是大表面積樣品分析的關鍵要求。分辨能力的提高可以通過補償解吸過程產生的初始動能來實現。使用延遲提取,半球形靜電扇形器件和反射鏡等技術可以在m/z 1000下將半峰寬(FWHM)質量分辨率增加到m/△m = 30 000。用于化合物鑒定的串聯質譜通常通過碰撞誘導解離(CID)或通過觀察電離后亞穩離子的衰變實現。為此,兩個獨立的ToF系統可以以所謂的ToF / ToF配置串聯。第一個ToF用于前體選擇,第二個ToF用于產物離子分析。
2. 傅里葉變換離子回旋共振質譜法
傅里葉變換離子回旋共振質譜(FT-ICR-MS)是一種離子捕獲技術,它決定了強磁場中潘寧離子阱中捕獲離子的回旋加速頻率。在外部離子源產生離子后,離子被轉移到潘寧離子阱中,直到進一步分析。使用寬帶射頻電激發,所有離子被激發到大的回旋加速軌道。它們的軌道半徑不僅增加,而在潘寧離子阱中,相同質荷比的離子也相互連貫地在軌道繞行。在繞行期間,它們可以在一組雙檢測電極中引起振蕩圖像電荷。該時域信號被數字化并進行傅里葉變換以產生回旋加速頻譜。質譜圖可以通過對回旋加速器方程w=qB/m校準產生。
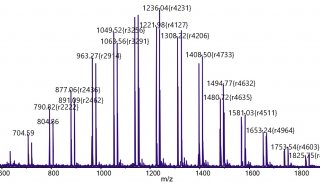
FT-ICR-MS的主要優點是具有無與倫比的質量分辨率和質量測量精度,可用于從MALDI圖像分析中發現新的結構細節。此外,使用捕獲離子技術不僅允許CID,而且允許紅外多光子解離(IRMPD)和電子捕獲解離用于串聯質譜的結構測定。分析速度受觀測時域信號的長度和相關質量分辨率的限制。質量分辨率取決于軌道離子的相干時間。典型的分析時間是每像素1 s,與所用的離子源無關。可以通過增加磁場強度來降低相同分辨率下的瞬態長度。MALDI組織成像實驗可以在FT-ICR-MS系統上進行,FWHM分辨率范圍從40000到400000。(圖2)。

3. MALDI離子遷移成像質譜法
通過MALDI生成離子的遷移分離,質譜圖中可以得到更多附加信息。離子遷移譜是基于離子通過碰撞橫截面面積的分離技術。在離子遷移質譜中,有充氣的漂移池用于質譜分析之前的離子分離,這些離子由于構象或組成變化而具有不同碰撞截面。當用于質譜成像時,除了空間維度和質譜維度之外,還增加了時間漂移的氣相分離維度。離子遷移光譜法在兩個主要方面有利于MALDI成像質譜的研究。首先,增加額外的分離維度能夠檢測到更多的質譜峰。離子遷移有利于減小質譜分析復雜度,并有助于不同種類化合物的分離,例如肽和磷脂。第二,質量與漂移時間選擇結合使得等壓肽或其它類似物分解為分裂譜。
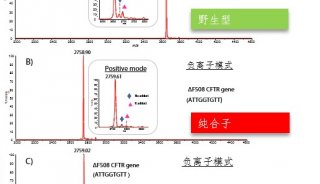
離子遷移、MALDI與用于IMS的ToF-MS組合,能夠通過其相關的消化肽片段定位和鑒定蛋白質。離子遷移分離可以鑒定通過常規MALDI-ToF-MS無法鑒定的等壓離子。與傳統的MALDI-ToF相比,該方法每次測量的觀察峰數量增加,能夠產生質量和時間選擇的離子圖像,同時可以對單個離子進行鑒定。圖3所示結果證明了離子遷移飛行時間成像質譜(IM-ToF-IMS)對來自組織的蛋白質鑒定的可行性。

組織消化與MALDI-IM-ToF-IMS方法相結合,可以對不同種類組織蛋白質鑒定實行“自下向上”的策略。
五、MALDI成像策略
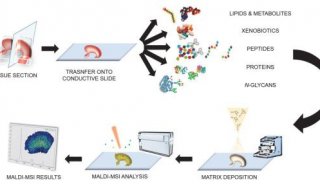
1. 質譜成像流程
不同解吸電離方法與不同質量分析器組合,為在單個組織樣品上進行互補實驗提供了可能性。
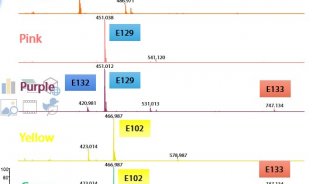
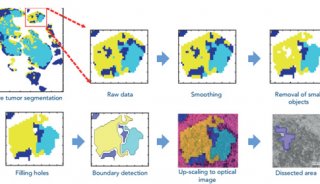
需要仔細的實驗設計來確保獲得相關的互補分子圖像信息。圖4中顯示的實驗工作流程提供了從單個組織生成六個補充圖像數據集的示例。在該示例中,通過外科手術獲得一塊組織。組織中的細胞表達熒光標記的蛋白質,因此成像工作流程中的步驟是產生熒光圖像。這提供了一種特定蛋白質的詳細位置。在將襯底表面上的10-20μm薄片進行組織切片和安裝之后,進行SIMS分析。這提供了在高空間分辨率下的低分子量成像MS數據。靜態SIMS除去表面材料的不到1%,因此殘留的表面仍然可以進一步分析。SIMS研究完成后,可以用基質涂層覆蓋組織表面(參見“基質涂層”一節)。根據感興趣的分析物,表面可以或不能被洗滌。洗滌方案對所得結果有重要影響。在圖4的實驗工作流程中,在基質沉積之前不進行洗滌以允許小的水溶性分子成像。在基質沉積后,進行的第一次分析是ME-SIMS。再次只有少量化合物分子從表面去除,晶體表面保持可用于后續的MALDI分析。ME-SIMS數據集提供了更大的完整有機分子(如脂質和分子量小于2000 Da的小信號分子)的信息。進行的下一個分析是具有略高于解吸閾值的激光注量的MALDI-ToF分析。 MALDI-ToF數據集包含有關內源性肽和完整蛋白的信息(取決于使用的洗滌方案和基質)。可以獲得的最后一個MS成像數據集是MALDI-FTICR-MS數據集(或離子遷移率圖像數據集)。這些技術需要去除大多數基質材料。它們可以提供高質量分辨率和質量精度信息,有助于識別構成圖像的分子。任何殘留的基質材料都可以從多次分析的表面上洗去,以便進行最終的H&E染色。這提供了其他的組織學信息,可以與成像質譜數據集結合來鑒定特定區域或組織類型。

2. 基體涂層
在MALDI和ME-SIMS分析之前,必須將基質溶液涂布于組織表面。基質溶液由有機溶劑如甲醇或乙腈組成,添加劑為弱有機酸如芥子酸(SA)或2,5-二羥基苯甲酸(DHB)和三氟乙酸(TFA)。加入TFA可增加分子的離子化質子的量。基質應用方法將強烈影響成像MS結果。應用方法將對靈敏度,表面擴散與空間完整性,空間分辨率,表面平坦度和分析速度產生影響。組織性質和環境參數影響組織中蛋白質的提取效率和基質的結晶。因此,控制基質沉積環境也是很重要。有幾個實驗室正在考慮創新的沉積方法,如基質升華。對于一般實驗室,一般有兩種基質沉積方法:點樣和噴涂。
2.1基質點樣
將基質溶液點樣到組織部分時需要將分析物的擴散限制在斑點大小范圍。已經開發了兩種基質檢測方法:手動或自動檢測。手動點樣產生微滴液滴,經常用于不需要生成圖像的MALDI組織分析。自動點樣使用更小的體積(pl)液滴,并產生約120-150μm的點樣尺寸和約200μm的最小分辨率。兩種不同類型的自動識別器用于基質沉積:噴墨式壓電噴嘴和使用聚焦聲波的液滴分配器。兩個噴射器都可以釋放100μl在組織上干燥成150μm直徑的液滴。在這種情況下,成像MS分析的分辨率通常會受到大于分析光束直徑的基質點樣點的限制。
2.2 基質噴涂
基質噴涂使均勻小滴的基質溶液覆蓋了樣品的整個表面。氣動、振動噴頭或電噴霧可以使基質溶液變生液滴噴霧。噴涂可以手動和自動化的方式進行。手動噴涂采用手持氣動噴槍或TLC噴霧器。通過噴霧裝置與x-y機器人聯用可以實現自動噴霧應用,也可以在較大的區域上進行基質沉積。使用振動噴霧器在較小的區域也可實現自動噴涂,其小型腔室主要控制濕度。噴涂后形成的晶體通常為10-20μm。為了獲得更小的晶體,可以使用電噴霧,減小敏感度產生甚至小于1μm的晶體。當使用噴霧沉積時,激光束的直徑限制了MALDI成像質譜的空間分辨率。
3. 鑒定策略
用于產生分子圖像的質譜峰的識別是所有質譜圖像策略中的關鍵步驟。選擇時候,可以使用高質量分辨率以及準確的質量進行測量。通常需要結合其他策略,如使用MALDI串聯質譜或其他分析策略來識別表面化合物種類。
3.1 MALDI串聯質譜法
串聯質譜使用是識別表面產生的不同化合物離子的合理選擇。限制因素是前體離子選擇的分辨率、裂解效率和方法靈敏度。在相同的位置,通常只能進行幾個質譜實驗。可以在單個位置進行的實驗數量仍然取決于提供信號的激光照射的數量。在相鄰位置執行串聯實驗的隔行掃描成像方法可部分克服此問題。一旦裂解模式已知,可以應用多重反應監測來確定化合物分布。
4. LC-MS / MS鑒定
研究可以使用互補組織勻漿和提取來產生組織成分的信息庫。也可以使用LC-MALDI來解決混合物復雜性的問題,增加靈敏度,以及降低離子抑制效應。
在直接MALDI成像實驗中觀察到的MALDI圖譜比較分析可以用作識別策略的一部分。在這些研究中,串聯MS可用于識別在LC-MALDI靶上發現的各個化合物成分。
-
產品技術

-
企業風采

-
產品技術
-
企業風采

-
招標采購