剛剛!2023年諾貝爾生理學或醫學獎揭曉 mRNA疫苗再掀熱潮
北京時間10月2日下午17點45分,2023年諾貝爾生理學或醫學獎獲獎者名單揭曉:Katalin Karikó 和 Drew Weissman,他們在核苷堿基修飾方面的發現,使新冠肺炎mRNA疫苗的研發成為可能。


2023年諾貝爾生理學或醫學獎被授予美國科學家Katalin Karikó和Drew Weissman,因為他們發現了核苷基修飾,從而開發出了有效的抗新冠肺炎病毒的mRNA疫苗。
這兩位諾貝爾獎獲得者的發現對于在2020年初開始的新冠肺炎大流行期間開發有效的mRNA疫苗至關重要。他們的突破性發現從根本上改變了我們對mRNA如何與免疫系統相互作用的理解,在現代人類健康面臨的最大威脅之一期間,兩位獲獎者為前所未有的疫苗開發速度做出了貢獻。
大流行前的疫苗
疫苗的基本原理是這樣的:通過接種疫苗產生刺激,促使人體產生對特定病原體的免疫反應,從在以后與真正病原體的接觸中處于領先地位。以滅活病毒或減毒病毒為基礎的疫苗早已問世,例如小兒麻痹癥、麻疹和黃熱病疫苗。1951年,馬克斯·泰勒(Max Theiler)因研制出黃熱病疫苗而獲得諾貝爾生理學或醫學獎。
由于近幾十年來分子生物學的進步,基于單個病毒成分而不是整個病毒的疫苗已經開發出來。病毒遺傳密碼的一部分通常編碼位于病毒表面的蛋白質,用于制造刺激病毒阻斷抗體形成的蛋白質,例如針對乙型肝炎病毒和人類乳頭瘤病毒的疫苗。或者,部分病毒遺傳密碼可以轉移到一種無害的載體病毒上,即“載體”,這種方法被用于制作對抗埃博拉病毒的疫苗。當注射載體疫苗時,選定的病毒蛋白在我們的細胞中產生,刺激針對目標病毒的免疫反應。
生產全病毒、蛋白和載體疫苗需要大規模的細胞培養,這種資源密集型過程限制了快速生產疫苗以應對疫情和大流行病的可能性。因此,研究人員長期以來一直試圖開發獨立于細胞培養的疫苗技術,但這被證明是具有挑戰性的。
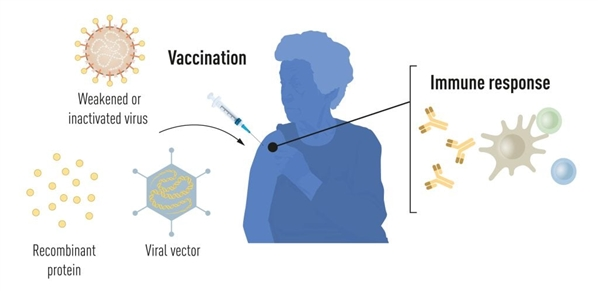
圖1:新冠肺炎大流行前的疫苗生產方法。圖片來自:諾貝爾生理學或醫學委員會/Mattias Karlén
mRNA疫苗:一個有希望的想法
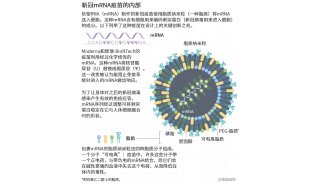
在我們的細胞中,DNA編碼的遺傳信息被轉移到信使RNA(mRNA)中,信使RNA被用作蛋白質生產的模板。在20世紀80年代,出現了無需細胞培養而產生mRNA的有效方法,稱為體外轉錄。這決定性的一步加速了分子生物學在多個領域的應用發展。將mRNA技術用于疫苗和治療目的的想法也開始興起,但前方仍有障礙。體外轉錄的mRNA被認為不穩定且難以遞送,需要開發復雜的脂質載體系統來封裝mRNA。此外,體外產生的mRNA容易引起炎癥反應,因此,最初人們開發用于臨床目的的mRNA技術的熱情是有限的。
這些障礙并沒有阻止匈牙利生物化學家Katalin Karikó,她致力于開發利用mRNA進行治療的方法。20世紀90年代初,當她還是賓夕法尼亞大學的助理教授時,盡管在說服研究資助者相信她的項目的重要性方面遇到了困難,但她仍然忠于自己的愿景,即實現mRNA的治療作用。Karikó的一位新同事是免疫學家Drew Weissman。他對樹突狀細胞很感興趣,樹突狀細胞在免疫監視和激活疫苗誘導的免疫反應中具有重要功能。在新想法的刺激下,兩人很快開始了富有成效的合作,重點研究不同類型的RNA如何與免疫系統相互作用。
突破
Karikó和Weissman注意到樹突狀細胞將體外轉錄的mRNA識別為外來物質,這導致它們被激活并釋放炎癥信號分子。他們想知道為什么體外轉錄的mRNA被識別為外源,而來自哺乳動物細胞的mRNA卻沒有引起同樣的反應。Karikó和Weissman意識到一定有一些關鍵的性質,能區分不同類型的mRNA。
RNA包含四種堿基,縮寫為A、U、G和C,分別對應遺傳密碼字母DNA中的A、T、G和C。Karikó和Weissman知道哺乳動物細胞RNA中的堿基經常被化學修飾,而體外轉錄的mRNA則沒有。他們想知道在體外轉錄的RNA中未被修飾的堿基是否可以解釋不想要的炎癥反應。為了研究這個問題,他們制造了不同的mRNA變體,每種變體的堿基都有獨特的化學變化,并將其傳遞給樹突狀細胞。結果是驚人的:當mRNA中包含堿基修飾時,炎癥反應幾乎被消除。這是我們對細胞如何識別和響應不同形式mRNA的理解的一個范式變化。Karikó和Weissman立即意識到他們的發現對于使用mRNA作為治療具有深遠的意義。這些開創性成果發表于2005年,比新冠肺炎大流行早了15年。
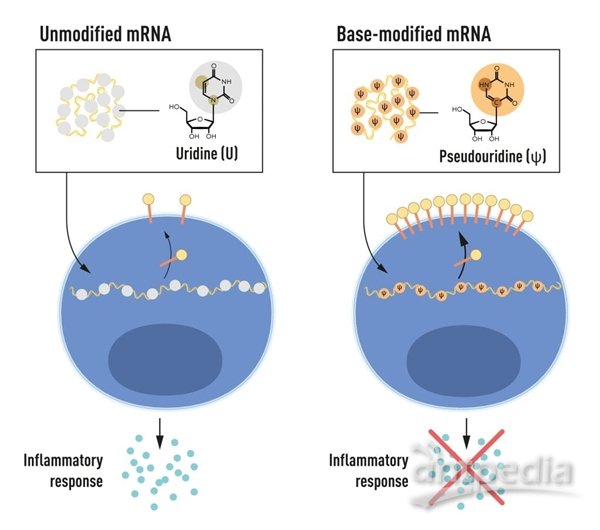
圖2:mRNA包含四種不同的堿基,縮寫為A、U、G和C。諾貝爾獎獲得者發現,堿基修飾的mRNA可以用來阻止炎癥反應的激活(信號分子的分泌),并在mRNA傳遞到細胞時增加蛋白質的產生。圖片來自:諾貝爾生理學或醫學委員會/Mattias Karlén
在2008年和2010年發表的進一步研究中,Karikó和Weissman表明,與未經修飾的mRNA相比,經堿基修飾產生的mRNA的遞送顯著增加了蛋白質產量。這種效果是由于一種調節蛋白質產生的酶的活性降低。Karikó和Weissman發現,堿基修飾既能減少炎癥反應,又能增加蛋白質的產生,從而消除了mRNA臨床應用道路上的關鍵障礙。
mRNA疫苗發揮了它們的潛力
人們對mRNA技術的興趣開始升溫,2010年,幾家公司開始致力于開發這種方法。研制寨卡病毒和中東呼吸綜合征冠狀病毒疫苗;后者與新冠肺炎病毒密切相關。新冠肺炎大流行爆發后,兩種編碼新冠肺炎病毒表面蛋白的堿基修飾mRNA疫苗以創紀錄的速度被開發出來。據報道,這兩種疫苗的保護效果約為95%,早在2020年12月就獲得了批準。
mRNA疫苗開發的靈活性和速度令人印象深刻,這也為利用新平臺開發其他傳染病疫苗鋪平了道路。在未來,這項技術還可能用于輸送治療性蛋白質,或治療某些類型的癌癥。
基于不同方法的其他幾種針對新冠肺炎病毒的疫苗也被迅速引入,全球共接種了130多億劑新冠肺炎疫苗。這些疫苗挽救了數百萬人的生命,并在更多人身上預防了嚴重疾病,使社會得以開放并恢復正常狀態。通過對mRNA堿基修飾重要性的根本性發現,今年的諾貝爾獎獲得者在我們這個時代最大的健康危機之一期間,為這一變革性發展做出了重大貢獻。
Katalin Karikó,1955年出生于匈牙利索爾諾克。1982年獲得塞格德大學博士學位,1985年在匈牙利科學院進行博士后研究。隨后,她在美國費城天普大學和貝塞斯達健康科學大學進行博士后研究。1989年,她成為賓夕法尼亞大學助理教授,直到2013年。之后,她成為BioNTech RNA Pharmaceuticals的副總裁和高級副總裁。自2021年以來,她一直擔任塞格德大學的教授和賓夕法尼亞大學佩雷爾曼醫學院的兼職教授。
Drew Weissman,1959年出生于美國馬薩諸塞州的列克星敦。他于1987年在波士頓大學獲得醫學博士學位。他在哈佛醫學院貝斯以色列女執事醫療中心接受臨床培訓,并在美國國立衛生研究院進行博士后研究。1997年,他在賓夕法尼亞大學佩雷爾曼醫學院成立了他的研究小組。他是疫苗研究的羅伯茨家族教授和賓夕法尼亞大學RNA創新研究所主任。
諾貝爾生理學或醫學獎近8年得主名單
2022年——瑞典科學家Svante P??bo獲獎,獲獎理由是“在已滅絕古人類基因組和人類進化方面的發現”。
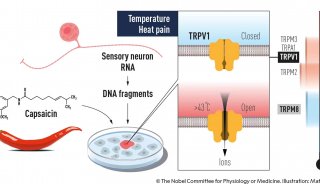
2021年——美國科學家David Julius、Ardem Patapoutian獲獎,獲獎理由是“發現溫度和觸覺的受體”。
2020年——美英三位科學家Harvey J. Alter、Michael Houghton和Charles M. Rice獲獎,獲獎理由是“發現丙型肝炎病毒”。
2019年——美英三位科學家William G. Kaelin Jr、Sir Peter J. Ratcliffe和Gregg L. Semenza獲獎,獲獎理由是“發現了細胞如何感知和適應氧氣的可用性”。
2018年——美國科學家James P. Allision和日本科學家Tasuku Honjo獲獎,獲獎理由是“發現了抑制負面免疫調節的癌癥療法”。
2017年——三位美國科學家Jeffrey C. Hall、Michael Rosbash和Michael W. Young獲獎,獲獎理由是“發現了調控晝夜節律的分子機制”。
2016年——日本科學家Yoshinori Ohsumi獲獎,獲獎理由是“發現了細胞自噬機制”。
2015年——中國科學家屠呦呦獲獎,獲獎理由是“有關瘧疾新療法的發現”;另外兩位獲獎科學家為愛爾蘭的William C. Campbell和日本的Satoshi ōmura,獲獎理由是“有關蛔蟲寄生蟲感染新療法的發現”。
諾貝爾生理學或醫學獎小知識
——從1901年到2022年,諾貝爾生理學或醫學獎共頒發了113次。未頒發的9年分別是1915、1916、1917、1918、1921、1925、1940、1941、1942年。
——113次頒獎中,40次為單獨獲獎者,34次為2人共享,39次為3人共享。
——從1901年至2022年,共225人獲獎。
——最年輕的獲獎者是加拿大科學家Frederick G. Banting,1923年因“發現胰島素”獲獎,時年32歲。
——最年長的獲獎者是美國科學家Peyton Rous,1966年因“發現腫瘤誘導病毒”獲獎,時年87歲。
——225位諾貝爾生理學或醫學獎得主中,有12位女性。分別是1947年的Gerty Cori,1977年的Rosalyn Yalow,1983年的Barbara McClintock,1986年的Rita Levi-Montalcini,1988年的Gertrude B. Elion,1995年的Christiane Nüsslein-Volhard,2004年的Linda B. Buck,2008年的Fran?oise Barré-Sinoussi,2009年的Elizabeth H. Blackburn和Carol W. Greider,2014年的May-Britt Moser,以及2015年的屠呦呦。
——截至2022年,無人獲得過諾貝爾生理學或醫學獎2次及以上。
——自1974年始,諾貝爾獎委員會章程明確規定,諾貝爾獎不頒發給去世科學家,除非去世發生在諾獎委員會發布獲獎公告之后。2011年諾貝爾生理學或醫學獎是迄今為止唯一的例外。當時諾獎委員會發現,當年獲獎者之一Ralph Steinman,在獲獎消息公布三天前已經去世。諾獎委員會研究章程后宣布,諾貝爾獎仍然頒發給Ralph Steinman,因為組委會發布獲獎公告時并不知曉他的去世消息。
——諾獎史上的“家庭”諾獎。
夫婦:Gerty Cori和Carl Cori夫婦獲得1947年的諾貝爾生理學或醫學獎;May-Britt Moser和Edvard I. Moser夫婦獲得2014年的諾貝爾生理學或醫學獎;
父子:Hans von Euler-Chelpin獲得1929年的諾貝爾化學獎,其子Ulf von Euler獲得1970年的諾貝爾生理學或醫學獎;Arthur Kornberg獲得1959年的諾貝爾生理學或醫學獎,其子Roger D. Kornberg獲得2006年的諾貝爾化學獎;Sune Bergstr?m獲得1982年的諾貝爾生理學或醫學獎,其子Svante P??bo獲得2022年的諾貝爾生理學或醫學獎。
兄弟:Jan Tinbergen獲得1969年的諾貝爾經濟學獎,其弟Nikolaas Tinbergen獲得1973年的諾貝爾生理學或醫學獎。
關于諾貝爾獎
1895年11月27日,瑞典著名化學家、硝化甘油炸藥發明人阿爾弗雷德·伯恩哈德·諾貝爾(Alfred Bernhard Nobel)簽署了他最后的遺囑,將財產中的最大一份給了一系列獎項,即諾貝爾獎。諾貝爾獎初始分設物理、化學、生理學或醫學、文學、和平等五個獎項。1968年,瑞典國家銀行在成立300周年之際,捐出大額資金給諾貝爾基金,增設“瑞典國家銀行紀念諾貝爾經濟科學獎”,俗稱諾貝爾經濟學獎。
諾貝爾獎的獎金來自諾貝爾所成立基金的利息或投資收益。隨著諾貝爾基金的收益變化,諾貝爾獎的獎金有所浮動。今年,2023諾貝爾獎的獎金增加了100萬瑞典克朗(約合65萬元人民幣),達到1100萬瑞典克朗(約合715萬元人民幣)。
-
焦點事件

-
焦點事件

-
科技前沿

-
焦點事件

-
科技前沿
-
項目成果
-
焦點事件

-
焦點事件

-
焦點事件

-
項目成果