李紅昌/喻學鋒/李洋合作利用黑磷納米材料靶向PLK1激酶
多年來,納米技術一直被視為一門擁有無限潛力的科學,并已經被廣泛應用于材料與制造、電子與信息技術、能源與環境、以及醫學與健康領域。伴隨著納米科學技術在各行各業的普遍應用,理解納米生物效應與安全性變得愈加重要,但相關研究卻始終處于早期階段。由于納米材料的大小與生物大分子非常接近,因此普遍認為納米材料能夠與多種生物分子發生相互作用。就其生物學結果而言,納米生物作用可具有正向效應和負向效應。正向納米生物效應,可以被用于開發新的納米藥物,將給疾病診斷和治療帶來新的機遇;而負向納米生物效應,則會對人體、生物乃至整個生態環境產生毒性,將造成嚴重的生物安全隱患。因此,研究納米材料與生物系統,特別是在細胞和分子層面的作用機理,對納米技術的正確應用至關重要。目前的納米生物學效應研究主要聚焦于材料表界面的物化性質誘導的生物學效應,這些效應通常為納米材料的普適性效應。但是,納米材料進入細胞后,如何影響細胞的功能?是否能夠與細胞內各種微尺度的生物分子發生相互作用?是否能夠影響具體的生物分子或信號通路?不同納米材料是否具有不同的生物靶向分子?對這些重要問題,目前還沒有非常明確的答案。
2021年8月5日,中國科學院深圳先進技術研究院李紅昌課題組,聯合喻學鋒課題組和李洋課題組合作在Nature Nanotech上發表文章 Intrinsic Bioactivity of Black Phosphorus Nanomaterials on Mitotic Centrosome Destabilization through Suppression of PLK1 Kinase ,充分發揮先進院學科交叉優勢,選取黑磷納米材料為研究模型,通過精細的細胞生物學和分子生物學研究,發現納米材料在細胞內可通過精準靶向某個具體生物分子,以獲得特定的生物效應。本研究提供了一個從分子細胞生物學維度深入研究納米材料精準生物靶向機制的全新路徑。深圳先進技術研究院副研究員邵喜明和研究助理丁智昊為論文并列第一作者,李紅昌研究員,喻學鋒研究員和李洋副研究員為論文共同通訊作者。
團隊首先發現使用低濃度黑磷納米材料處理細胞,能夠導致細胞分裂特異停滯在細胞周期的有絲分裂M期。細胞周期是細胞分裂的基本機理。整個細胞周期分為四個時期,每次分裂都嚴格按照G1,S,G2,M的順序進行,其中每個過程都受到眾多信號通路的精細調控。黑磷納米材料導致細胞周期停滯在細胞周期中時程最短的M期,意味著納米材料對M期的某個關鍵細胞器或某條關鍵信號通路功能進行了特異干擾,因此非常可能是一種材料特異的納米生物學效應。隨后,團隊對這一現象背后的機理進行了深入挖掘,發現黑磷納米材料造成有絲分裂核心細胞器——中心體(centrosome)的分離受到阻滯。這一機制被最終確定為黑磷納米材料導致細胞分裂M期停滯的直接原因。

圖1:細胞有絲分裂過程中,遺傳物質的精準分配起始于紡錘體核心器件---中心體的正確分離。黑磷納米材料進入分裂期細胞后,通過靶向并抑制中心體的分離,導致細胞分裂被阻斷在分裂早期。
黑磷納米材料導致的細胞周期阻斷效應可以完全媲美于已經發現的靶向細胞分裂M期的特異小分子藥物,因此團隊進一步探索了黑磷納米材料是否有特定的生物靶向分子。通過一系列生物化學和細胞生物學研究,團隊最后確認有絲分裂激酶PLK1是黑磷納米材料的生物效應靶點。黑磷納米材料可以特異結合PLK1,并抑制其激酶活性,從而阻斷了細胞分裂M期的正常進行。

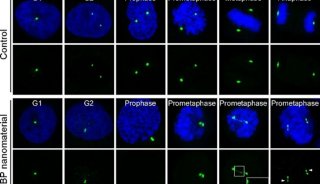
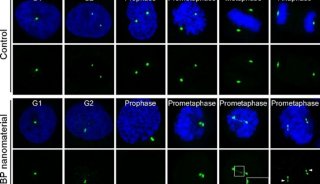
圖2:PLK1是控制中心體正確分離的關鍵激酶,黑磷納米材料在細胞內能夠與PLK1蛋白結合,促進其異常聚集,導致PLK1無法被有效募集到中心體位置進行活化,最終影響了中心體的正常分離。a,黑磷納米材料處理細胞減弱了PLK1在中心體的定位。b-c,黑磷納米材料明顯減緩了PLK1向中心體的動態募集。
很多納米生物學效應與納米材料的尺寸、形狀、表界面電荷等物理性質相關。本團隊發現黑磷納米材料的細胞周期阻斷效應與材料的尺寸和形狀無關,但與材料的水解活性密切相關。對各種磷基納米材料的研究發現,具有較好水解活性的磷基納米材料都表現出與黑磷相似的生物效應,而水解活性差的磷基納米材料則沒有類似效應。由于磷基納米材料水解會產生磷酸根,因此材料表面必會吸附大量磷酸根,這與細胞內生物大分子的磷酸化修飾非常相像,而蛋白質磷酸化修飾恰好是PLK1底物蛋白與PLK1結合的必備條件,因此細胞內PLK1很可能將表面富含磷酸根的納米材料誤認為底物蛋白進行了結合,最終導致其激酶活性被這些納米材料所抑制。
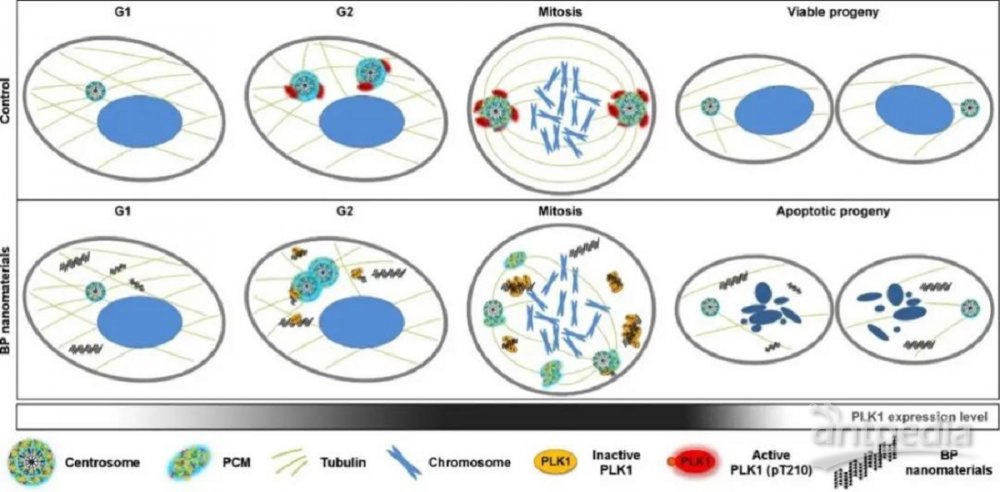
圖片圖3:黑磷納米材料抑制細胞有絲分裂進行的分子細胞機制:黑磷納米材料通過靶向細胞分裂關鍵激酶PLK1,抑制其向中心體位置的轉移和活化,造成中心體正常分離被抑制,并引發中心體碎片化,進而導致多極紡錘體形成,最終抑制了細胞有絲分裂的完成。
抑制細胞周期是理想的抗腫瘤策略。黑磷納米材料作為一種新型PLK1抑制劑,在實驗動物模型中展現出了優秀的腫瘤抑制效果。因此假以時日,黑磷納米材料非常有可能發展成為一個臨床可用的抗腫瘤納米藥物。最重要的,本項目研究結果明確展示了納米材料能夠通過精準靶向特定生物分子進而獲得特異的納米生物學效應,因此必將帶動納米領域對不同納米材料的內在生物學效應和分子細胞機制進行廣泛研究,最終為納米精準藥物的研發開辟全新路徑。
-
精英視角

-
產品技術

-
企業風采

-
科技前沿
-
政策法規
-
科技前沿