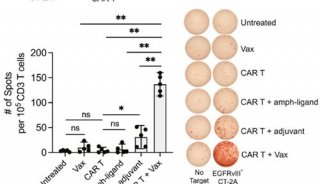
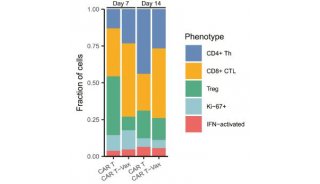
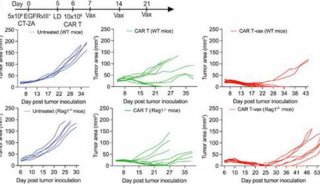
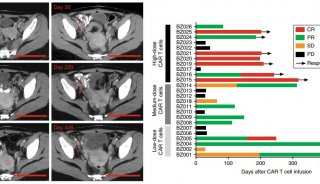
提升CAR-T細胞抗異質性腫瘤活性方面新進展
中國科學院廣州生物醫藥與健康研究院研究員李鵬課題組與暨南大學李揚秋課題組合作,通過在傳統CAR分子內引入DAP10分子調動內源NKG2D的廣譜抗原識別功能,提升CAR-T細胞對異質性腫瘤的靶向能力。課題組近日在Molecular Therapy – Oncolytics上發表了研究論文。
CAR-T細胞在治療血液腫瘤方面取得重大突破,但是對實體腫瘤的療效卻不佳,實體腫瘤的異質性是阻止CAR-T細胞治療實體瘤的一大障礙。為減少CAR-T療法中因腫瘤異質性導致的免疫逃逸和腫瘤復發,亟需改進和優化CAR分子對不同抗原的廣譜識別功能。NKG2D是CD8陽性T細胞中表達的一種可識別多種配體的受體,DNAX激活蛋白10(DAP10)同NKG2D受體互作向T細胞傳遞信號。研究團隊猜想,可以利用這一受體的特性增強CAR-T細胞對異質性腫瘤的細胞毒性作用。
研究團隊首先設計了一種串聯DAP10的嵌合分子,實驗表明該嵌合分子可利用T細胞上的天然NKG2D受體靶向表達NKG2D配體的腫瘤細胞;之后將其與抗GPC3單鏈可變片段(scFv)串聯,構建雙靶點嵌合抗原體系,發現表達串聯GPC3-DAP10嵌合受體的T細胞表現出雙抗原靶向作用,在體內外可明顯抑制異質性腫瘤細胞生長。
以上結果說明,使用全長DAP10分子替代傳統CAR分子內部的跨膜序列,可以讓CD8陽性T細胞內源表達的NKG2D受體參與腫瘤的識別與殺傷。因為NKG2D受體是一個具有多抗原識別能力的受體,所以該設計思路顯著增加了傳統CAR-T細胞對腫瘤細胞的廣譜識別能力,減小了在CAR-T治療中腫瘤免疫逃逸的可能性。因此,該研究中構建的雙靶點CAR-T細胞具有提升CAR-T細胞抗異質性腫瘤細胞活性的能力,為臨床免疫細胞治療實體腫瘤提供新策略。
該研究工作主要由廣州生物院博士生李尚霖和暨南大學博士后趙若聰為共同完成,李鵬和李揚秋為該論文的共同通訊作者。該研究得到國家自然科學基金、國家重點研發計劃、廣東基礎與運用基礎研究基金和廣東省新藥創制項目的支持。

雙靶點CAR-T細胞殺傷異質性腫瘤細胞示意圖
-
焦點事件

-
科技前沿

-
項目成果