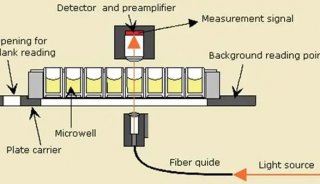
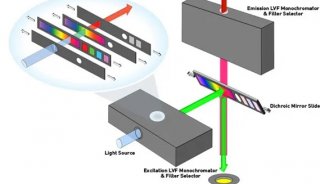
如何用酶標儀進行bca蛋白定量
BCA蛋白定量和 Bradford法蛋白定量的區別:
1、Bradford法測得的主要是堿性氨基酸和芳香族氨基酸,BCA則沒有選擇性
2、BCA法蛋白濃度定量是二價銅離子在堿性的條件下,可以被蛋白質還原成一價銅離子(biuret reaction),一價銅離子和獨特的BCA Solution A(含有BCA)相互作用產生敏感的顏色反應。兩分子的BCA螯合一個銅離子,形成紫色的反應復合物。該水溶性的復合物在562nm處顯示強烈的吸光性,吸光度和蛋白濃度在廣泛范圍內有良好的線性關系,因此根據吸光值可以推算出蛋白濃度。
Bradford法蛋白定量是染料與蛋白質結合后引起染料最大吸收的改變,從465nm變為595nm,光吸收增加。蛋白質染料復合物具有高的消光系數,因此大大提高了蛋白質測定的靈敏度,最低檢出量為1μg蛋白。染料與蛋白質的結合是很迅速的過程,大約需2min,結合物的顏色在1h內是穩定的。一些陽離子,如K+,Na+,Mg2+,(NH 4 ) 2 SO 4,乙醇等物質不干擾測定,而大量的去污劑如TritonX100,SDS等嚴重干擾測定,少量的去污劑可通過用適當的對照而消除。由于染色法簡單迅速,干擾物質少,靈敏度高,現已廣泛應用于蛋白質含量的測定。
推薦
-
企業風采

-
焦點事件

-
焦點事件