東華大學團隊:探索 NIR-II 熒光成像引導的膠質母細胞瘤治療
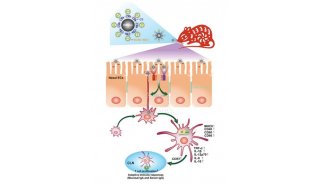
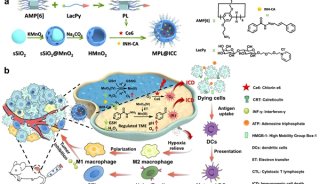
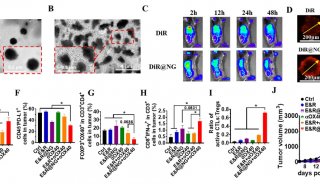
膠質母細胞瘤(GBM)是最致命的原發性腦腫瘤之一,但其診斷和治愈性治療仍然是一個巨大的挑戰。2024年8月19日,東華大學李靜超團隊在Advanced Science在線發表題為“Neutrophil-Targeting Semiconducting Polymer Nanotheranostics for NIR-II Fluorescence Imaging-Guided Photothermal-NO-Immunotherapy of Orthotopic Glioblastoma”的研究論文。該研究報道了中性粒細胞靶向半導體聚合物納米治療劑(SSPNiNO)用于小鼠模型中原位膠質母細胞瘤的第二種近紅外(NIR-II)熒光成像引導的三模態治療。SSPNiNO基于兩種半導體聚合物形成,分別充當NIR-II熒光探針和光熱轉換劑。熱響應性一氧化氮(NO)供體和腺苷2A受體(A2AR)抑制劑共同整合到SSPNiNO中以實現三模態治療作用。SSPNiNO表面附著有中性粒細胞靶向配體,以“特洛伊木馬”方式介導它們有效遞送到原位GBM部位,從而實現高靈敏度的NIR-II熒光成像。在NIR-II光照射下,SSPNiNO通過NIR-II光熱效應有效產生熱量,不僅可以殺死腫瘤細胞并誘導免疫原性細胞死亡(ICD),還可以觸發受控NO釋放以增強腫瘤ICD。此外,封裝的A2AR抑制劑可以通過阻斷腺苷-A2AR通路來調節免疫抑制腫瘤微環境,從而進一步增強抗腫瘤免疫作用,從而明顯抑制原位GBM進展。本研究可為NIR-II熒光成像引導的有效GBM治療提供具有累積治療作用的多功能診療納米平臺。
膠質母細胞瘤(GBM)是一種常見的來源于膠質細胞的惡性腦腫瘤,年發病率為3-4/10萬,約占所有膠質瘤的49%。GBM的標準治療策略通常包括最大限度的手術切除,隨后進行放療和化療的聯合治療。由于GBM的浸潤性生長模式和異質性,該治療策略未能顯著改善GBM患者的預后,患者中位生存期極低,僅為<21個月。因此,迫切需要開發新的GBM治療策略。免疫治療通過有效清除癌細胞、誘導免疫記憶以防止復發,在膠質母細胞瘤治療領域引起了廣泛關注。然而,免疫治療對膠質母細胞瘤的療效受到免疫抑制腫瘤微環境和血腦屏障(BBB)的強大屏障的嚴重影響。膠質母細胞瘤是一種免疫冷性腫瘤,其腫瘤微環境以腫瘤浸潤淋巴細胞數量少和免疫抑制細胞水平高為特征。此外,效應免疫細胞包括樹突狀細胞(DC)、細胞毒性T淋巴細胞(CTL)和抗腫瘤巨噬細胞的活性受到免疫抑制腫瘤微環境的抑制。膠質母細胞瘤的這種“冷”表型可以通過治療誘導的免疫調節作用部分逆轉。例如,某些化療藥物,如米托蒽醌,已被證明可在腫瘤中引發免疫原性細胞死亡(ICD)細胞,導致DC成熟并隨后激活CTL。然而,化療的潛在副作用仍然存在,應探索一些更安全的ICD誘導策略來增強GBM的免疫治療。光熱療法(PTT)在包括GBM在內的各種癌癥的治療中具有巨大的前景。特別是,第二近紅外(NIR-II)生物窗口(1000–1700 nm)中的PTT對深部腦腫瘤的治療具有獨特的優勢,因為NIR-II光具有增強的穿透能力(3–5cm深度)。除了通過光熱效應直接殺死腫瘤細胞外,PTT還可以通過觸發ICD效應和激活免疫細胞來促進針對GBM的抗腫瘤免疫反應。然而,由于腫瘤細胞的熱阻和對附近正常細胞的潛在熱損傷,PTT誘導的ICD通常很弱。因此,已經提出將PTT與氣體療法等其他方式相結合以加強免疫療法。一氧化氮(NO)作為一種氣體信號分子,已成為免疫抑制腫瘤微環境的有前途的調節劑。先前的研究表明,NO可以促進巨噬細胞極化的轉變,從而使它們從免疫抑制M2表型轉變為抗腫瘤M1表型,T細胞浸潤增強,程序性死亡配體1表達降低,并有效觸發ICD效應。因此,NO療法已被廣泛用于增強癌癥免疫治療。盡管NO和PTT協同治療策略已顯示出較高的抗腫瘤療效,但它們的結合以增強GBM治療的免疫療法的探索卻很少。
將成像能力集成到治療平臺中,可以顯著提高治療精度,這引起了人們對腫瘤治療的越來越多的關注。盡管磁共振等臨床成像方法提高了膠質母細胞瘤的檢出率,但這些成像方式仍然存在腫瘤描繪的時間和空間分辨率不足,以及可能有害的電離輻射。這些缺點極大地影響了它們描繪浸潤性膠質瘤組織與周圍健康腦組織的能力。另一方面,熒光成像因其高靈敏度和選擇性而引人注目,使其有利于在術中可視化膠質瘤和健康組織之間的邊界。具體而言,NIR-II熒光成像具有深層組織穿透、強大的時空分辨率和增強的成像對比度的優點,因此在GBM檢測方面具有巨大的前景。考慮到明顯的優勢,有必要探索NIR-II熒光成像引導的GBM聯合治療的可能性。本研究設計了基于半導體聚合物(SP)的納米治療診斷劑,用于NIR-II熒光成像引導的原位GBM光熱-NO免疫治療。為了增加GBM靶向能力,將中性粒細胞靶向配體唾液酸(SA)共價連接到納米治療診斷劑上(圖1a)。中性粒細胞可以穿過BBB并滲透到膠質瘤腫瘤中,因此SA結合可以介導BBB穿越并通過結合到中性粒細胞表面來提高納米治療診斷劑進入GBM部位的遞送效率。這些納米治療診斷劑包含兩個SP,分別用于在NIR-II激光照射下實現GBM的NIR-II熒光成像和NIR-IIPTT。產生的熱量殺死腫瘤細胞并觸發熱響應NO供體釋放NO以實現PTT氣體治療,通過誘導ICD效應使GBM腫瘤敏感(圖1b)。這種納米治療診斷技術通過遞送腺苷2A受體(A2AR)抑制劑來調節膠質母細胞瘤的免疫抑制微環境,從而進一步增強抗腫瘤免疫反應。因此,NIR-II熒光成像引導的光熱-NO-免疫療法對膠質母細胞瘤治療顯示出較高的療效。
參考消息:https://onlinelibrary.wiley.com/doi/10.1002/advs.202406750
-
科技前沿
-
焦點事件

-
科技前沿
-
項目成果
-
項目成果

-
項目成果
-
項目成果