纖維素酶復合物介紹
在許多細菌中,體內的纖維素酶是在超分子復合物(纖維素小體)中組織起來的復雜酶結構。它們可以包含但不限于五種不同的酶亞基,代表即內切纖維素酶、外切纖維素酶、纖維二糖酶、氧化纖維素酶和纖維素磷酸化酶,其中只有外切纖維素酶和纖維二糖酶參與β(1→4)鍵的實際水解。組成纖維素體的亞單位的數量也可以決定酶活性的速率。
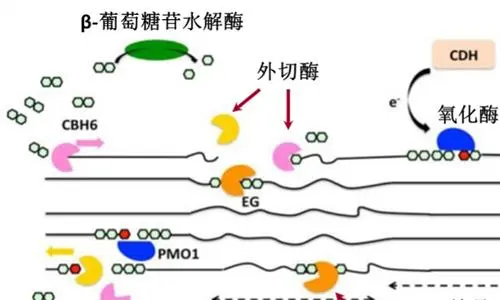
多域纖維素酶在許多分類群中廣泛存在,然而,在纖維素體中發現的來自厭氧細菌的纖維素酶具有最復雜的結構,由不同類型的模塊組成。例如,Clostridiumcellulolyticum產生13種GH9模塊化纖維素酶,其中包含不同數量和排列的催化域(CD)、碳水化合物結合模塊(CBM)、dockerin、接頭和Ig樣域。
例如,來自里氏木霉的纖維素酶復合物包含標記為C1的組分(57,000道爾頓),其分離結晶纖維素鏈、內切葡聚糖酶(約52,000道爾頓)、外切葡聚糖酶(約61,000道爾頓)和β-葡糖苷酶(約61,000道爾頓)道爾頓)。
在產生纖維素體的細菌基因組中已經鑒定出許多被稱為dockerins和cohesins的“特征”序列。根據它們的氨基酸序列和三級結構,纖維素酶分為氏族和科。
由于酶與纖維素底物之間的緊密接近,多模塊纖維素酶比游離酶(只有CD)更有效,這是由于協同作用。CBM參與纖維素的結合,而糖基化接頭為CD提供靈活性,以提高活性和蛋白酶保護,并增加與纖維素表面的結合。
推薦




















