接連在頂刊發文的顏寧,擬獲全國表彰
近日,中華全國總工會將2024年全國五一勞動獎和全國工人先鋒號擬表彰對象予以公示。其中,深圳醫學科學院院長、深圳灣實驗室主任、教授顏寧擬獲全國五一勞動獎章。

“全國五一勞動獎章”是全國總工會為獎勵在社會主義各項建設事業中作出突出貢獻的職工而頒發的榮譽獎章。被授予“全國五一勞動獎章”的職工,由全國總工會頒發獎章、證書和獎金。
稍早前,顏寧已進入廣東省總工會關于廣東省2024年全國五一勞動獎和全國工人先鋒號擬推薦對象的公示名單中。
據廣東省總工會提供的資料,顏寧,女,漢族,1977年11月生,群眾,現任深圳醫學科學院院長、深圳灣實驗室主任、清華大學講席教授、中國科學院院士。
顏寧主要致力于跨膜運輸蛋白的結構與機理研究,在國際上首次揭示人源葡萄糖轉運蛋白、真核生物電壓門控鈉離子通道和鈣離子通道等一系列具有重要生理與病理意義跨膜蛋白的原子分辨率結構,為理解相關疾病的致病機理及藥物開發提供了分子基礎。其科研成果獲得海內外同行廣泛認可。
她推動深圳醫學科學院各項建設。完成深圳醫學科學院籌建,于2023年10月獲批正式成立。受市政府委托管理深圳市醫學研究專項資金,完成首年評審與立項,資助總金額近2億元。引進美國冠名講座教授陳宙鋒等7位學術帶頭人。舉辦7次SMART Symposia,邀請數位諾獎得主在內的100余名中外院士、頂尖專家匯聚光明科學城。成立深圳市光明致遠科技基金會。
她推進深圳灣實驗室高質量發展。打造多維度科研評估體系,對PI全覆蓋開展國際化學術評估,對研發管線項目和特色技術平臺進行評審。引進海內外一流人才達100余人,獲批博士后獨立招收資格,獲科技部引才引智示范基地、廣東省科普教育基地等榮譽稱號10多項。
PNAS 、Cell 顏寧團隊接連發表高水平文章
今年以來,顏寧教授領導的清華大學/深圳醫學科學院團隊在PNAS、Cell等高影響因子期刊上發表了多篇高水平的科研文章,進一步證明了她在科研領域的深厚實力和突出成就。
以下是部分最近研究發表:
2024年4月11日——
清華大學/深圳醫學科學院顏寧團隊在Cell Research(IF=44)在線發表題為“Structural basis for human Cav3.2 inhibition by selective antagonists”的研究論文,該研究展示了Cav3.2單獨和與四種T型鈣通道選擇性拮抗劑復合物的冷凍電鏡結構,總分辨率從2.8 ?到3.2 ?。這四種化合物表現出兩種結合姿態。
ACT-709478和TTA-A2均將其含環丙基的末端置于中心腔中,直接阻斷離子流動。TTA-P2和ML218將其3,5-二氯苯酰胺基團投射到II-III孔中,并將其疏水尾部放置在腔中以阻止離子滲透。穿孔穿透模式立即為這些拮抗劑的狀態依賴性活動提供了解釋。結構導向突變分析確定了決定這些藥物T型偏好的幾個關鍵殘基。這些結構也表明內源性脂質在穩定藥物在中央腔內結合中的作用。

電壓門控鈣(Cav)通道響應膜去極化,允許Ca2+內流并將電信號轉化為細胞內Ca2+介導的事件。它們在Ca2+依賴的生理過程中發揮重要作用,如神經遞質/激素釋放、基因表達和肌肉收縮。鈣通道活性的精確控制涉及多種細胞因子,如受體、鈣調蛋白、磷脂和G蛋白。此外,這些通道可以被一系列離子、毒素和許多臨床和研究藥物調節。
在哺乳動物的10種Cav亞型(Cav1.1-Cav1.4、Cav2.1-Cav2.3和Cav3.1-Cav3.3)中,Cav3亞家族也被稱為T型鈣通道,與大而持久的l型Cav1通道相比,其特點是電流微小且短暫。與需要多個輔助亞基來進行通道活動的Cav1和Cav2成員不同,T型通道獨立起作用。此外,Cav1和Cav2通道在高壓下被激活,因此也被稱為高壓激活(HVA)通道,而Cav3通道是低壓激活(LVA)通道。LVA和HVA通道之間的序列差異很大程度上支持了它們的功能差異,為開發亞型特異性調節劑提供了潛在藥物發現的機會。
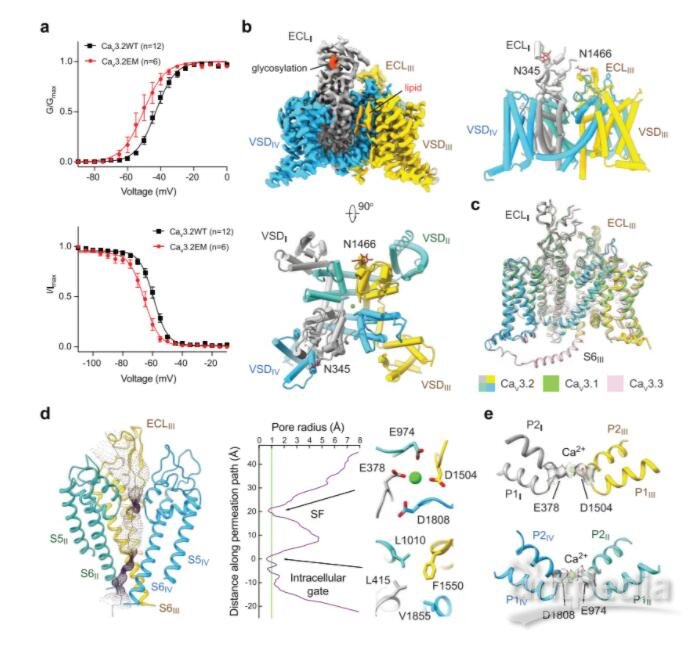
人Cav3.2的冷凍電鏡結構分析(圖源自Cell Research )
Cav3.2由CACNA1H編碼,廣泛表達于中樞神經系統,調節神經元興奮性,參與傷害感受。其活性的改變與許多神經和神經精神疾病有關,包括特發性全身性癲癇和疼痛。研究表明,在各種炎癥性和神經性疼痛模型中,脊髓背角和背根神經節神經元中Cav3.2的表達和/或活性增加沉默或藥物抑制Cav3.2通道可誘導嚙齒動物鎮痛。因此,Cav3.2正在成為下一代鎮痛藥開發的一個有希望的藥物靶點。靶向Cav3.2的化合物,如乙磺酰亞胺、米貝弗拉迪、丙戊酸、唑尼沙胺、吡莫胺和某些二氫吡啶(DHPs),在嚙齒動物急性、炎癥和慢性疼痛模型中顯示出療效。
目前正在研究各種具有新型化學骨架的小分子作為潛在的鎮痛候選藥物,如Z944、TTA-A2、TTA-P2、ML218和ACT-709478。與通常對T型通道特異性有限的已批準藥物相比,這些正在研究的T型特異性阻滯劑對T型Cav通道具有更強的親和力。盡管這些化合物尚未區分T型亞型,但與Cav3.1和Cav3.3相比,Cav3.2獨特的藥代動力學特性為開發真正的Cav3.2選擇性分子提供了機會。
獲得與FDA批準的藥物或先導化合物復合的通道結構的高分辨率洞察對于指導從頭藥物設計或優化至關重要。Cav3.1結合先導化合物Z944的結構揭示了T型鈣通道的基本結構和Z944.44狀態依賴性抑制Cav3亞家族的分子基礎。最近關于Cav3.3與米貝弗拉迪、吡莫胺和奧替溴銨配合物結構的報道拓寬了靶向T型鈣通道的藥物識別譜。該研究試圖確定人類Cav3.2單獨和與代表性拮抗劑復合的結構,特別關注那些對T型鈣通道具有增強選擇性的結構。
3月28日——
2024年3月28日,清華大學/深圳醫學科學院顏寧、清華大學閆創業及潘俊敏共同通訊在Cell 在線發表題為“Structure-guided discovery of protein and glycan components in native mastigonemes”的研究論文,該研究報道了從萊茵衣藻纖毛中分離的天然纖絨毛 (Mastigoneme) 3.0 ?分辨率的冷凍電鏡結構。
長莖形成一個超級螺旋,每個螺旋旋轉由四對反平行的纖絨毛素樣蛋白1 (Mst1)組成。在Mst1中,在II型聚羥基脯氨酸(Hyp)螺旋周圍發現了大量阿拉伯糖聚糖,它們代表了植物和藻類中常見的一類糖基化。EM圖譜揭示了纖絨毛軸心蛋白(Mstax),該蛋白富含重度糖基化的Hyp,并含有PKD2樣跨膜結構域(TMD)。Mstax有近8000個殘基,從細胞內區域到纖絨毛素的遠端,為Mst1的組裝提供了框架。該研究提供了對天然生物結構中蛋白質和聚糖相互作用復雜性的見解。

纖毛,或鞭毛,突出到細胞外環境服務于雙重目的檢測環境的變化和促進細胞運動。一些單細胞原生生物的纖毛排列有側毛,稱為纖絨毛。先前的研究表明,纖絨毛可能參與機械刺激的感知。它們還可以通過增加纖毛在蛙泳運動時的有效表面積來增強纖毛推進力。
有管狀和非管狀纖絨毛。管狀纖絨毛屬通常長1毫米,直徑15-19納米,相對堅硬,而非管狀纖絨毛屬較短(0.8毫米),較薄(10納米),柔韌,易脫落。衣單胞菌纖毛上的非管狀纖絨毛素被認為與多囊腎病蛋白(PKD2)(也稱為多囊素-2 [PC-2])有關,多囊素-2是一種瞬時受體電位(TRP)家族通道,其跨膜區域共享電壓門控離子通道(VGIC)折疊。在哺乳動物細胞的初級纖毛上,PKD2的三個亞基與PKD1(也稱為PC-1),(具有巨大的多結構域胞外區域)組合形成異源四聚體。然而,PKD1/PKD2異構體的生理功能尚不完全清楚,該異構體是否具有通道活性仍存在爭議。預測衣藻上的纖絨毛是由重度糖基化的纖絨毛樣蛋白1 (Mst1)組成的螺旋狀聚合物。由于纖絨毛的高分辨率結構的缺乏,完整的組件,準確的組裝,以及與PKD2潛在相互作用的細節仍然是未知的。此外,聚糖的結構或功能作用仍然難以捉摸。
糖基化是翻譯后修飾(PTM)的一種主要形式,它顯著地擴展了蛋白質的結構復雜性和功能多樣性。糖化蛋白參與多種生物過程,如信號傳導、免疫反應和細胞分化。在核酸、蛋白質、脂質和碳水化合物這四種主要的生物分子中,后兩者是結構生物學最具挑戰性的目標。糖基化通常通過點突變或去糖基化來去除,以改善基因的均勻性蛋白質結晶。使用單粒子冷凍電鏡(cryo-EM)進行結構分析,可以保存糖基化。然而,由于多糖鏈固有的柔韌性,在EM圖中只能分辨出靠近修飾殘基的幾個糖基。碳水化合物結構信息的缺乏嚴重限制了人們對一類主要生物分子的理解。
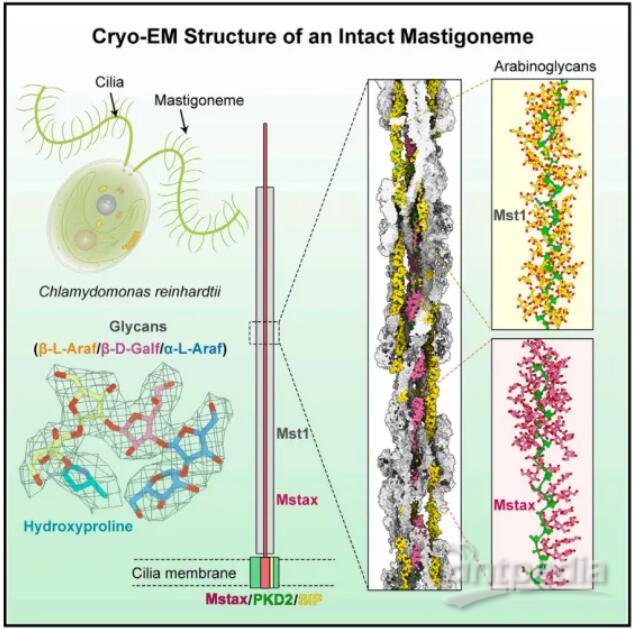
機理模式圖(圖源自Cell )
為了擴大人們對糖蛋白和天然生物結構的了解,作者利用單粒子冷凍電鏡(cryo-EM)研究了萊茵衣藻(Chlamydomonas reinhardtii)內源纖絨毛的組裝,并獲得了3.0 ?的重建。除了交織在一起的Mst1原纖維的高階低聚物外,出色的EM圖譜還能夠鑒定出作為纖絨毛中心軸的蛋白質。研究人員將這種高度糖基化、富含羥脯氨酸(Hyp)的大蛋白命名為纖絨毛特異性軸蛋白Mstax。對Mstax未解析片段的結構預測顯示,在近膜區和跨膜區存在PKD2樣褶皺,從而為纖絨毛和PKD2之間的相互作用提供了合理的分子基礎。該研究提供了對天然生物結構中蛋白質和聚糖相互作用復雜性的見解。
3月5日——
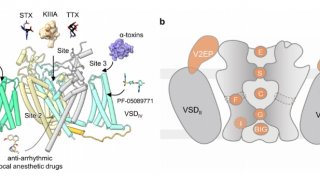
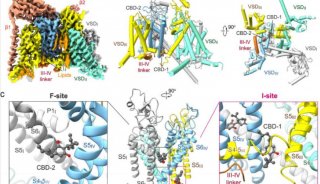
2024年3月5日,清華大學/深圳醫學研究院顏寧團隊在Cell Research 在線發表題為“Structural basis for different ω-agatoxin IVA sensitivities of the P-type and Q-type Cav2.1 channels”的研究論文,該研究揭示了不同ω-agagoxin IVA靈敏度的P型和Q型Cav2.1通道的結構基礎。
該研究報告了Cav2.1單獨和與MVIIC或Aga-IVA復合物的冷凍電鏡結構,總分辨率為2.9-3.1 ?。這些結構揭示了兩種選擇性肽毒素選擇性抑制Cav2.1的分子決定因素,為亞型特異性治療的發展奠定了基礎。

由CACNA1A編碼的P/Q型Cav通道Cav2.1普遍存在于神經元和神經內分泌細胞中,在神經遞質的釋放、突觸可塑性和神經元興奮性的調節中起重要作用。Cav2.1是治療神經系統疾病(如癲癇和偏頭痛)的潛在治療靶點P/Q型的定義源于它們最初分離的細胞類型,P型來自小腦浦肯野細胞,Q型來自小腦顆粒細胞。P/Q類型可以通過不同的失活動力學和對ω-agatoxin IVA (Aga-IVA)的不同敏感性來區分Aga-IVA可有效阻斷P型通道,kD值為1 ~ 2 nM,而Q型通道的敏感性較弱。有報道稱,在第四個電壓感應域(VSD)連接S3和S4片段的環中插入Asn-Pro (NP)基序的CACNA1A的選擇性剪接(在VSDIV中稱為S3-4IV環)可顯著降低Aga-IVA的敏感性。除AgaIVA外,ω-concontoxin MVIIC (MVIIC)可選擇性有效抑制P/Q型通道。
研究人員首先檢測了人Cav2.1全長在α2δ-1和β3輔助亞基存在下的通道活性。電壓相關的Ba2+ (IBa)電流的穩態激活和失活特性分別為-9.64 ± 0.30 mV和-63.08 ± 0.98 mV。結構分析顯示,MVIIC在選擇性過濾器(SF)上方的外口被明確地分離出來,Aga-IVA附著在VSDIV的細胞外周。為簡化說明,將Cav2.1與MVIIC和Aga-IVA的復合物分別稱為Cav2.1-M和Cav2.1-A。
Cav2.1的整體結構與Cav2.2和Cav2.3非常相似,具有一個低的VSDII和一個磷脂酰肌醇4,5-二磷酸(PIP2)分子結合在VSDII和孔域(PD)之間的間隙上。PD閉合的胞內門進一步由Cav2特有的重復序列II的細胞質螺旋(CHII螺旋)保護。盡管整體結構相似,但某些區域,特別是重復序列I和IV中的細胞外環(ECLs)存在明顯差異,這與這些區域的序列變化一致。ECLs中的差異是Cav2通道對各種肽毒素的獨特敏感性的基礎。
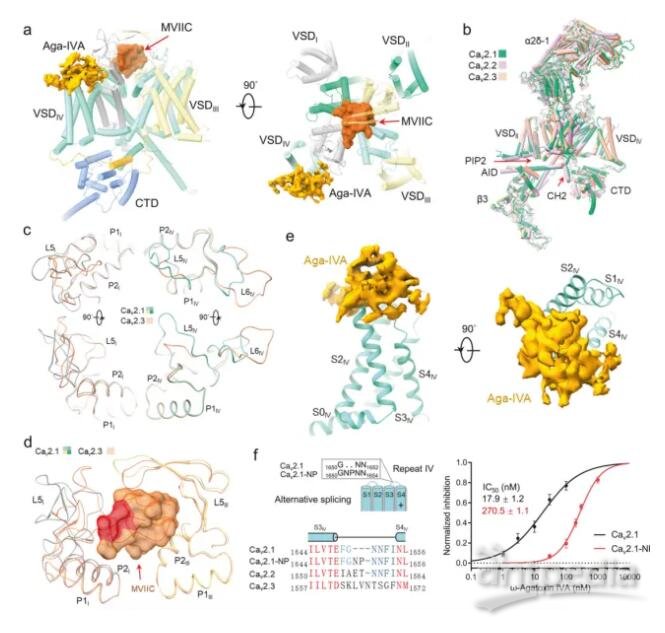
Aga-IVA和MVIIC亞型選擇性抑制Cav2.1的結構基礎(圖源自Cell Research )
在Cav2.1-M的結構中,MVIIC位于SF的正上方,有效地阻斷了Ca2+的進入途徑。這種作用機制類似于MVIIC對Cav2.2的作用機制。MVIIC與Cav2.1的相互作用主要由P1和P2螺旋上的極性殘基和帶電殘基以及ECLs介導。Cav2.1-M和Cav2.1-A的結構比較表明,ECLI和ECLIV都略微向外移動以容納MVIIC。在Cav2.2中,MVIIA結合后也觀察到類似的運動然而,局部結構的變化可能并不總是足以創造空間兼容性。事實上,在Cav2.1和Cav2.3之間,ECLI和ECLIV的序列和結構都有很大的不同。Cav2.3的ECLI更靠近中軸線,可能與MVIIC產生不可避免的沖突。這就解釋了Cav2.3對MVIIC不敏感的原因。
值得注意的是,Cav2.2和Cav2.3中的S3-4IV環差異很大,這解釋了它們對Aga-IVA不敏感的原因。Aga-IVA粘附于含有NP的S3-4IV環的結構觀察,從而解釋了不同Cav2亞型和Cav2.1剪接變異體的不同敏感性的物理基礎。結構比較顯示,在Aga-IVA結合時,S4IV向胞內側輕微向外運動,S4IV向胞內側半螺旋旋轉運動。由于Cav通道中的VSDs在靜息狀態下應呈“下”構象,結構觀察表明Aga-IVA可能通過抑制VSDIV的激活來阻斷通道。綜上所述,該研究揭示了MVIIC和Aga-IVA對Cav2.1亞型特異性阻斷的分子機制,為P型和Q型Cav2.1通道對Aga-IVA的不同反應提供了結構解釋,并為開發更有效和選擇性的神經疾病調節劑提供了見解。
2月21日——
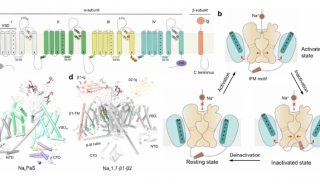
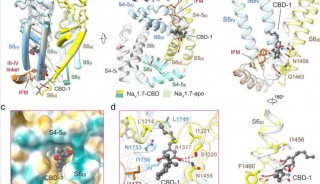
清華大學/深圳醫學科學院顏寧團隊在PNAS 在線發表題為“Dissection of the structure–function relationship of Nav channels”的研究論文,為了描述人類Nav通道的結構-功能關系,該研究以人類Nav1.7為原型進行了系統的結構分析。根據野生型(WT) Nav1.7與含有11個突變的變體Nav1.7 -M11之間的結構差異,該研究生成了另外三個中間突變體,并以2.9-3.4 ?的總分辨率求解了它們的結構。
在孔域(PD)上有9個點突變的突變體被命名為Nav1.7-M9,其空腔體積減小,門密封,所有電壓感應域(VSD)保持在上。WT和Nav1.7-M9的結構比較指出了兩個可能對PD收緊至關重要的殘基。然而,包含這兩個突變的變體Nav1.7-M2,甚至與VSD中另外兩個突變Nav1.7-M4結合,都未能使PD收緊。該結構分析表明,靜態失活I-V曲線的右移與PD收縮的趨勢相關。研究人員預測靜息狀態下的通道應該有一個“緊”的PD和低的VSD。

真核電壓門控鈉(Nav)通道通過以動作電位的形式啟動和傳播電信號來控制膜的興奮性。在靜息狀態下,可興奮細胞(如神經元和肌細胞)的膜呈負電位極化。靜止狀態下的Nav通道是不導電的。它們響應膜去極化而激活。確保動作電位重復放電的關鍵機制是Nav通道的快速失活,這種失活發生在激活后的一毫秒或幾毫秒內。失活通道在膜超極化后返回靜息狀態,為下一個工作周期做準備。
由于其在生理學上的基礎意義,鈉通道的異常功能或調節與大量的致病性疾病有關,如癲癇發作、心律失常和疼痛障礙。因此,Nav通道代表了一類主要的藥物靶點。不同功能狀態下NaV通道的結構解析不僅對深入了解電信號的基本生理過程至關重要,而且對NaV靶向藥物的開發也至關重要。
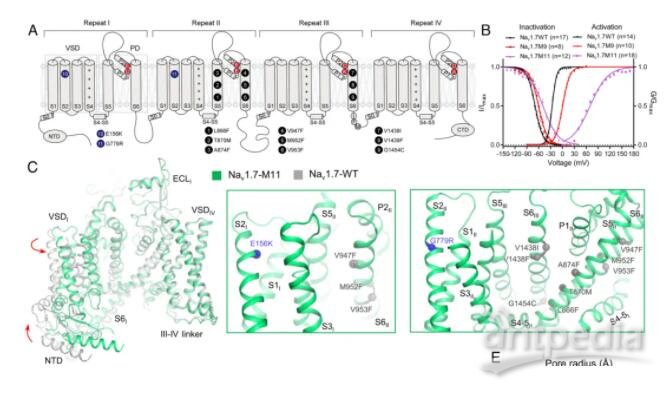
結構-功能關系研究中Nav1.7變體的合理設計概覽(圖源自PNAS )
與其他電壓門控陽離子通道一樣,Nav通道由兩個模塊組成,一個是負責選擇性和門控離子滲透的中心孔域(PD),另一個是檢測膜電位變化并相應地發生構象變化的電壓感應域(VSDs)。一般認為,靜息狀態下的Nav通道具有一個封閉的PD,有四個“向下”的VSD,其中S4段上的門控電荷殘基面向胞內側。Nav通道的激活是指由VSD向上運動引起的孔打開。具有孔門控的VSD協同運動被稱為機電耦合。從物理角度來看,NaV本質上是多個構象的集合,每個構象都可以由調制器特定地識別。
到目前為止,人類Nav通道的八個亞型的結構,Nav1.1-Nav1.8已被報道。然而,大多數報道的結構表現出類似的失活構象,具有非導電PD和四向上VSD的特征。Nav通道結構生物學的主要挑戰是揭示機電耦合過程中與不同狀態相關的構象。為了實現這一目標,研究人員一直在使用人類NaV1.7作為支架,并利用多種策略,如引入點突變和包含狀態依賴性毒素或藥物。
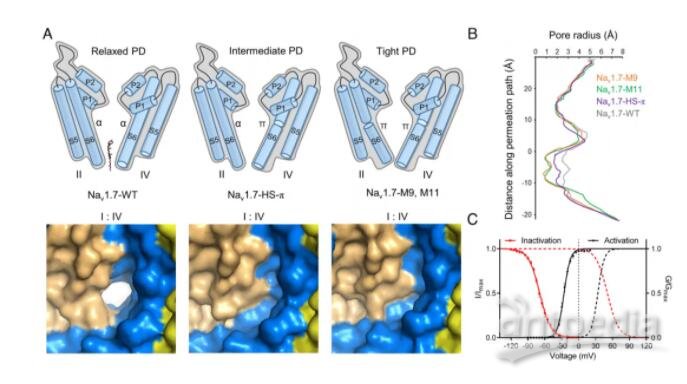
Nav通道PD的結構-功能關系(圖源自PNAS )
最近的一項嘗試是用NavPaS的對應物合理地替代一些Nav1.7殘基,這是第一個確定原子結構的真核Nav通道。與人類的Nav通道相比,NavPaS異構體的結構與人類的Nav不同,PD更收縮,VSDs處于中間狀態。當Nav1.7的PD上的9個位點被NavPaS的殘基取代時,得到的變體Nav1.7-M9(簡稱M9)在激活和靜態失活時都顯示出右移的I-V曲線。當與VSDI和VSDII的另外兩個突變結合時,變體Nav1.7-M11的這些I-V曲線的右移更為顯著。基于這些I-V曲線,研究人員預測純化后的M11在沒有任何膜電位的情況下,可能是封閉狀態失活(CSI)構象。事實上,M11-class I的結構與野生型通道(Nav1.7-WT)有很大的差異。此外,VSDII通過一個門控電荷向細胞內移動。為簡單起見,除非另有說明,否則NaV1.7-M11或M11將參考M11 -I類的結構。
該研究試圖剖析11個點突變對WT和M11之間結構變化的貢獻。除了M9,該研究還生成了兩個額外的變體,Nav1.7-M2包含兩個PD突變,其衍生物Nav1.7-M4與M11一樣具有兩個額外的VSD突變。該研究對這些Nav1.7突變體的系統結構檢查提供了Nav1.7通道結構-功能關系的最新觀點。這些結構突出了PD與非導電態相關的構象復雜性。