谷歌AlphaFold 3重磅問世,預測精準度提高100%,AI 能幫助治療癌癥和免疫病

剛剛,頂級科學期刊英國《Nature》(自然)雜志發表了一份重磅、突破性研究論文。
北京時間5月8日23點,谷歌DeepMind和其英國子公司Isomorphic Labs聯合團隊在《自然》雜志上發表一份共46頁的成果,推出全新AI蛋白質結構預測模型AlphaFold 3,可準確預測生物分子相互作用的結構。
具體來說,新的AlphaFold 3擁有更強的生成式AI模型能力,效果全面提升。對于蛋白質與其他分子的相互作用,與現有預測方法相比,AlphaFold 3改進了至少50%;對于一些重要的相互作用領域,AlphaFold 3預測精(準確)度提高一倍(100%),從而對蛋白質、核酸、小分子、配體、修飾殘基等更廣泛生物分子的復合物進行聯合結構預測,有望幫助人們治療癌癥、免疫性疾病等。
本論文共同監督作者、谷歌DeepMind聯合創始人、CEO戴密斯?哈薩比斯(Demis Hassabis)表示,對于團隊來說,AlphaFold 3的發布是一個重要的“里程碑”,同時也是用 AI 技術“理解和建模生物學”道路上邁出的重要一步。
“相比此前研究,AlphaFold 3不僅能夠模擬蛋白質與其他分子的相互作用,而且還能準確預測包括DNA、RNA、配體等生物分子結構以及它們如何相互作用,從而能改變我們對生物世界和藥物發現的理解,這非常重要。這是我們和Isomorphic共同正在推進的事情。我們非常自豪地在《自然》雜志新論文中宣布這些新突破發現、新結果和新方法。”Demis Hassabis表示。

Nature發表關于AlphaFold 3的論文研究截圖
六年構建超180萬人的蛋白質數據庫、節省數萬億美金
AlphaFold 3模型預測精準再提升一倍
據悉,AlphaFold是由谷歌DeepMind開發的一款蛋白質結構預測程序,它采用 AI 和深度學習技術僅根據其基因序列就能預測蛋白質的3D結構,僅需數日內可識別蛋白質的形狀,從而找到藥物靶點,并有望推進產生新的小分子藥物。而在此之前,這通常需要數年時間、數億美元的投入。
AlphaFold 1于2018年發布,其在CASP(蛋白質結構預測的關鍵評估)競賽中成功預測了43種蛋白質中25種蛋白質的最精確結構,排名第一,并認為成功預測了最困難目標的蛋白質結構,引發全球的關注。
2020年,全新AlphaFold 2發布,并同步推出AlphaFold數據庫,涵蓋了人類和20種常用模式生物的35萬個蛋白質結構,并且對98.5%的人類蛋白質結構進行了準確預測。同時,超過2.14億個預測中約有35%被認為是高度準確的,這意味著它們與實驗確定的結構一樣好,另外45%被認為對于許多應用來說足夠準確。
2022年7月,AlphaFold 2全面升級,DeepMind公司與歐洲生物信息研究所(EMBL-EBI)的合作團隊宣布,基于UniProt數據庫序列,AlphaFold預測出約100萬個物種的2億多個蛋白質結構,幾乎涵蓋了所有科學已知的蛋白質。相關研究成果發表在《自然》雜志上。
據Demis Hassabis披露的一份官方數據顯示,截至目前,AlphaFold數據庫用戶已達180萬人次,覆蓋超190個國家,已查看的結構超600萬次,論文和數據引用次數超過20000次。
谷歌DeepMind反復強調,通過減少緩慢而昂貴的實驗的需求,AlphaFold可能為研究界帶來了數億年的進步,并節省了數萬億美元。數百萬研究人員全球范圍內已經使用 AlphaFold 2 在瘧疾疫苗、癌癥治療和酶設計等領域取得了發現。

6年后的今天,AlphaFold 3終于來了。
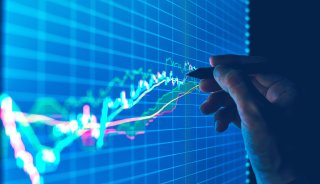
此次公布的AlphaFold 3,官方定義為一種由神經網絡架構組成、擁有能夠高精度預測包含蛋白質數據庫(PDB) 中幾乎所有分子類型復合物的“生成式 AI 模型”。
AlphaFold3是如何揭示生命分子的?
該研究在AlphaFold2的基礎上推出了AlphaFold3,能夠以前所未有的準確度預測所有生命分子的結構和相互作用(包括蛋白質、核酸、小分子、離子)。在蛋白質-配體相互作用方面的預測精度遠高于當前最先進的分子對接工具,在蛋白質-核酸相互作用方面的預測精度遠高于專門針對核酸的預測工具,在抗體-抗原相互作用方面的預測精度也顯著高于AlphaFold-Multimer v2。
AlphaFold3的強大功能源于其新一代的架構和訓練,涵蓋了生命中所有分子。AlphaFold3的核心是一個改進版的Evoformer模塊(一種蛋白質語言模型),在處理輸入后,AlphaFold 3使用擴散(diffusion)網絡進行預測(類似于AI繪圖或ChatGPT生成文字),擴散過程從一團原子云開始,經過許多步驟后,最終生成最準確的分子結構。其對分子相互作用的預測準確度超過了所有已有的系統。
引領藥物研發新革命
AlphaFold3能夠通過對藥物分子(例如與蛋白質結合的配體和抗體)的預測,為藥物設計賦能,從而改變人類健康和疾病過程中蛋白質的相互作用方式。
AlphaFold3在預測藥物相互作用方面達到了前所未有的準確度,包括蛋白質與配體的結合以及抗體與靶蛋白的結合。AlphaFold3在不使用任何結構信息的情況下,比最好的傳統方法在PoseBusters基準測試中的準確率提高了50%,這使得AlphaFold3成為第一個在生物分子結構預測方面超越基于物理學工具的AI系統。而預測抗體-蛋白質結合的能力對于理解人類免疫反應的各個方面以及設計新型抗體藥物至關重要。
Isomorphic Labs正在使用AlphaFold3以及一系列自主研發的AI模型,為內部項目以及與制藥公司合作進行藥物研發。AlphaFold3能夠在幾秒鐘內生成高度精確的結構預測,為藥物研發人員提供了快速準確預測從未被表征的復雜結構的能力,從而大大加速藥物研發進程。
Isomorphic Labs在日常工作中使用AlphaFold3并發現:
1.針對AlphaFold3的結構預測設計小分子,有助于設計出能有效結合靶蛋白的分子。
2.AlphaFold3提高了蛋白-蛋白相互作用結構的準確性,為設計新的治療模式(如抗體或其他治療性蛋白質)打開了可能性。
3.通過觀察目標蛋白在完整生物環境中(與其他蛋白質、DNA、RNA或配體的結合)的結構,可以更深入地了解新靶點,有助于開發更有效的臨床藥物。
科學界可以免費使用
DeepMind推出了AlphaFold?Server平臺,全世界的科學工作者都可以免費使用(非商業用途)這一全球范圍內最精準的結構預測工具,只需點幾下鼠標,就可以利用AlphaFold3預測蛋白質、DNA、RNA以及一系列配體、離子和化學修飾組成的結構模型。
DeepMind表示,該平臺為研究人員提供了一種便捷的方式來生成預測模型,無論他們是否擁有計算資源或人工智能方面的專業知識,從而幫助他們加快工作流程,促進科學創新。
在AlphaFold出現之前,往往需要耗費整個博士生階段,并花費數十萬美元,才能解析一個蛋白質的精確三維結構。而AlphaFold2僅僅用了不到3年時間就已經成功預測了數億個蛋白質結構,幾乎覆蓋了地球上所有已知的蛋白質,以當前的結構生物學實驗進度,完成這一工作量可能需要耗費十億年時間。
開啟AI賦能的細胞生物學的未來
AlphaFold3將生物世界帶入了高清時代,它使科學家們得以觀察復雜的細胞系統,包括結構、相互作用和修飾等。這一生命分子的新窗口揭示了它們是如何相互關聯的,并有助于理解這些聯系如何影響生物功能——例如藥物的作用、激素的產生和DNA的修復等過程。
AlphaFold3以及免費開放的AlphaFold Server平臺,將通過AI的強大能力賦能科學家加速解決生物學中的開放性問題和新的研究方向。
AlphaFold3還有多大潛力,我們拭目以待...
AlphaFold3的結構預測案例
下圖展示了AlphaFold3對普通感冒病毒(冠狀病毒OC43)刺突蛋白(藍色)與抗體(綠松石色)和單糖(黃色)相互作用時的結構,預測結構與真實結構(灰色)準確吻合。

下圖展示了AlphaFold3對蛋白質(藍色)與DNA雙螺旋(粉色)結合的分子復合物的預測,與真實分子結構(灰色)幾乎完美匹配。

下圖展示了AlphaFold3對RNA修飾蛋白復合物的結構預測,該復合物包含一個蛋白質(藍色)、一條RNA鏈(紫色)和兩個離子(黃色),預測結果與真實結構(灰色)非常吻合。

下圖展示了AlphaFold3對一種分子復合物的結構預測,該復合物包含一種酶蛋白(藍色)、離子(黃色球體)和單糖(黃色),預測結果與真實結構(灰色)非常吻合。這種酶存在于一種土壤寄生真菌(大麗輪枝菌)中,會損害多種植物,了解這種酶與植物細胞的相互作用有助于研究人員培育更健康、更具抗性的作物。

作者也指出了一些局限性,比如約4.4%的結構會出現不正確的手性(一種對稱特性),或是幻覺導致“飄帶”(一種常見的蛋白質二級結構元素)的出現減少。他們補充道,模擬準確率的進一步提升需要生成一個很大的預測集并對預測結構進行排序,而這會產生額外的計算成本。
論文鏈接:https://www.nature.com/articles/s41586-024-07487-w