神經穩態可塑性的調控機制方面取得進展
在國家自然科學基金項目(批準號:81971022)等資助下,上海市精神衛生中心-中科院上海藥物研究所聯合實驗室周子凱研究員與加拿大多倫多大學/多倫多兒童醫院Zhengping Jia教授團隊合作在神經穩態可塑性的調控機制方面取得進展,發現了驅動神經穩態可塑性的神經營養因子NGPF2及相關分子機制。研究成果以“NGPF2 通過ALK-LIMK-cofilin觸發突觸縮放的機制(NGPF2 triggers synaptic scaling up through ALK-LIMK-cofilin-mediated mechanisms)”為題,于2021年8月17日在線發表在《細胞報告》(Cell Reports)雜志上。論文鏈接:https://doi.org/10.1016/j.celrep.2021.109515。
神經系統的穩態可塑性(homeostatic plasticity)是指當神經元或神經網絡的興奮性處于持續改變狀態時,神經元會主動啟動程序化的分子和細胞反應,對突觸功能進行相應的代償性雙向調節以對抗神經網絡的持續性改變,從而使得突觸傳遞和神經興奮性維持在相對穩定的水平,維持正常的神經功能。神經穩態可塑性參與調控多種重要的生理過程,其異常可導致神經網絡的興奮-抑制失衡及功能障礙,與抑郁癥、孤獨癥、精神分裂癥等神經精神疾病的發生密切相關。然而,神經系統的穩態可塑性這一機制到底是如何啟動的,至今仍不清楚。
研究團隊使用河豚毒素阻斷體外培養的原代皮層神經元的動作電位,剝奪神經活性;然后分析神經元的蛋白質分泌組(secretome)構成,發現分泌組中的促神經軸突生長因子2(neurite growth-promoting factor 2, NGPF2)短暫且急劇升高。發現在神經失活條件下,脆性X智力低下蛋白1(fragile X mental retardation protein 1,FMRP1) 調控的蛋白翻譯機制快速合成NGPF2并大量分泌到外周,進而激活受體酪氨酸激酶ALK,引起下游LIMK-cofilin介導的細胞骨架重組,以支撐突觸傳遞的增強及樹突棘成熟,最終表現為神經活性剝奪所引起的代償性突觸功能增強。NGPF2在神經活性剝奪初期的快速合成及分泌是啟動突觸放大這一神經穩態可塑性的充分且必要條件(圖1)。
目前報道的常見神經營養因子的表達合成均與神經活性水平呈正相關,而該研究發現的NGPF2是首個報道的由神經失活誘導表達的神經營養因子,提示NGPF2動態調節的異常很可能參與神經網絡的興奮-抑制失衡及以持續性神經失活為主要病理過程的疾病進展,為相關研究提供了新思路。
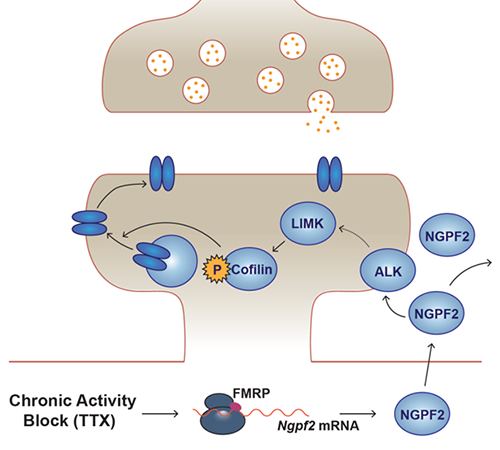
圖1. 神經活性剝奪引起NGPF2的合成釋放并引發突觸放大的機制模式圖











