實驗室分析方法--反向液相色譜法原理及發展
反相液相色譜(RPLC)是分離大多數常規樣品的首選分離模式,它比其他液相色譜分離模式的適用范圍更寬、更方便。據統計,在高效液相色譜法中,70%~80%的樣品可采用反相鍵合相色譜法完成。極性、非極性,水溶性、油溶性,離子性、非離子性,小分子、大分子,以及具有官能團差別或分子量差別的同系物,均可采用反相液相色譜技術實現分離。
一、原理及色譜柱推薦
反相色譜固定相的極性弱于流動相,樣品在極性流動相和非極性固定相間分配,疏水性強(非極性)的化合物保留較強,流動相組成一定時,樣品按照其疏水性由弱到強的順序流出色譜柱。
用于反相色譜分離的固定相一般通過在基質(包括高純硅膠、有機聚合物、石墨化碳及有機-無機雜化材料等)表面共價鍵合有機硅烷或沉積聚合物有機涂層,其中應用最為廣泛的是硅膠基質的化學鍵合相固定相,也可對多孔聚合物微粒加以改性得到不同選擇性的反相譜固定相,如修飾了
C18烷基側鏈的聚丙烯酰胺、聚甲基丙烯酸的烷基酯化物、聚乙烯醇的酯化物、C18烷基鍵合的聚乙烯醇、C18烷基衍生的交聯聚苯乙烯以及苯基或烷基衍生的羥基化聚醚樹脂等。
化學鍵合反相色譜中,隨著鍵合相疏水基團鏈長的增加或疏水性的增加而增大。鍵合烷基的鏈長對鍵合相的樣品負荷量、溶質的容量因子及其選擇性有不同的影響,當烷基鍵合相表面濃度(mol/m2)相同時,隨著烷基鏈長增加,溶質的保留值增加。烴基鏈長可以是C2、C4、C6、C8、C16、C18、C22、C30等,圖1為ODS(C18)的空間結構示意圖。ODS有較高的碳含量和好的疏水性,對各種類型的樣品分子有較強的適應能力,從非極性的芳烴到氨基酸、肽、兒茶酚胺和許多藥物的分析皆可適用。
從圖1可見,疏水性烷基鏈幾乎全部覆蓋在基質硅球的表面。一般認為,反相色譜普的分離機理為液液分配過程。但也有人證實,對不同的樣品,采用ODS色譜柱進行分離,可能同時存在吸附和分配兩種機制,且隨樣品結構及流動相組成的變化而變化。圖2描述了溶質在ODS表面的行為。弱溶劑水不與疏水性的C18鏈產生強的相互作用,強溶劑可以將溶質從固定相上頂替下來。

圖1 ODS空間結構示意圖
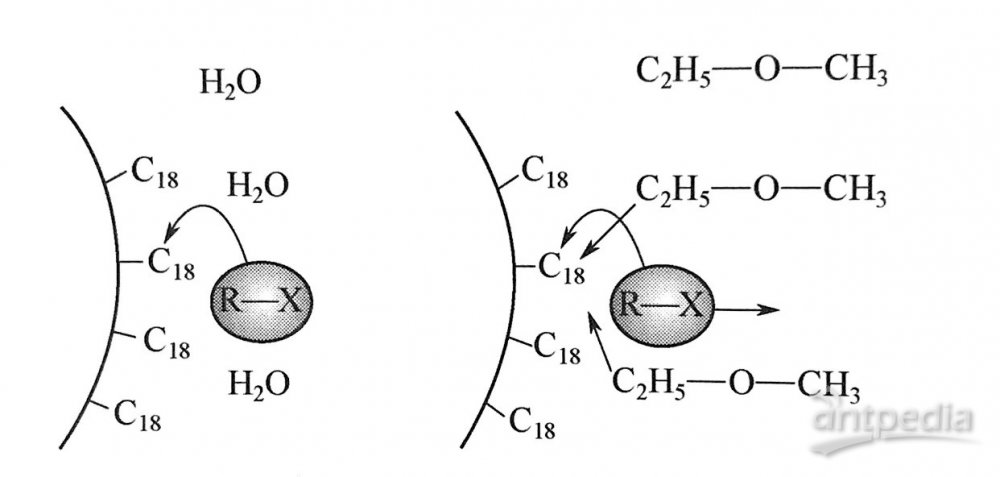
圖2 溶質在ODS表面的行為
多環芳烴鍵合相與C18性質接近,適合于芳香族化合物的分離。鍵合短鏈烷基(C3、C4)的大孔硅膠(20~40nm)鍵和含氟硅烷鍵合相的發展滿足了蛋白質、酶等生物大分子分離的需要。由于碳氟鍵的極性比碳氫鍵更強,氟的引入使鹵代化合物或其他極性化合物在固定相上保留更強,分離選擇性也會發生變化。全氟烷基鍵合固定相可以應用于表面活性劑分析、超臨界流體色譜、離子對分離等方面。不經過特殊衍生處理的石墨化碳固定相作為反相色譜固定相,除了可以在低或高pH值條件下運行外,還可同時實現高溫快速分離。
短鏈烷基(C6、C8)硅烷由于分子尺寸較小,與硅膠表面鍵合時可以有比長鏈烷基更高的覆蓋度和較少的殘余羥基,適合于極性樣品的分析。為適應蛋白質、酶等生物大分子分離的需要,一些鍵合有短鏈烷基(C3、C4)的大孔硅膠(20~40nm)鍵合相也發展起來。與C18相比,C4、C8等的疏水性較弱,因此對于溶質的保留隨碳鏈的加長而逐漸增強,見圖3。
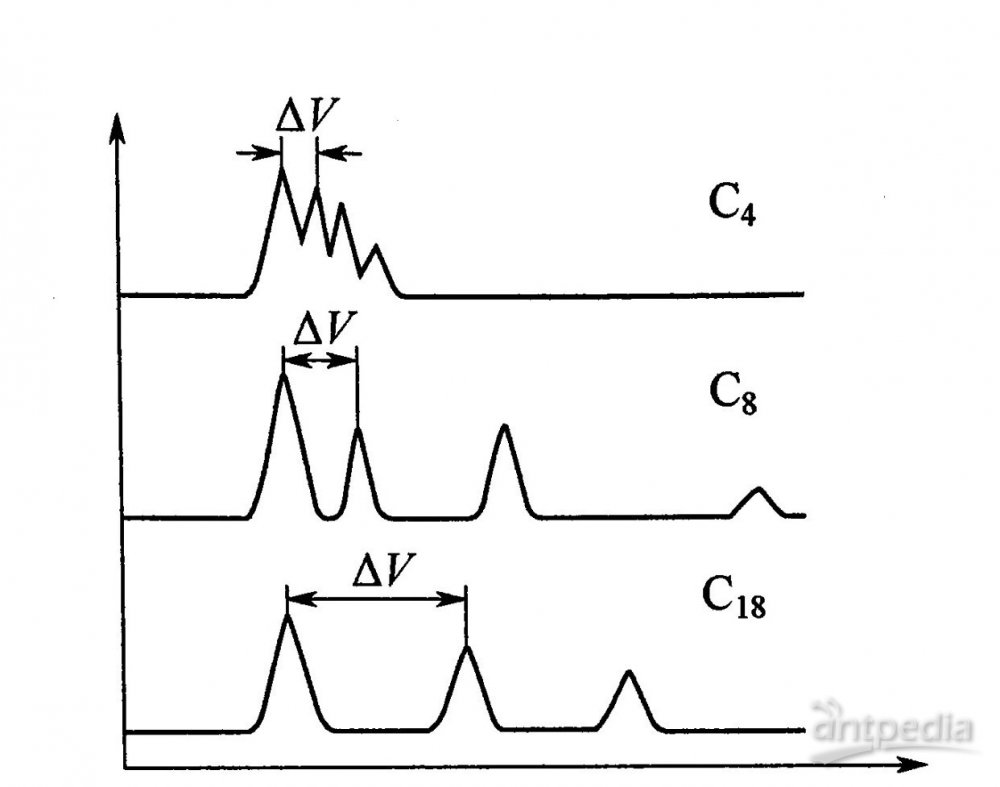
圖3 溶質保留值隨固定相修飾碳鏈接長度的變化
硅膠鍵合固定相對堿性化合物的吸附主要是表面殘余硅羥基和微量不純金屬雜質的作用,采用金屬雜質含量極低的硅膠作為制備鍵合固定相的基質能夠部分改善固定相性能。在色譜分離中,可通過在流動相中添加胺改性劑、降低流動相pH值、增加流動相離子強度、加入離子對試劑等方法消除殘余硅羥基的作用。此外,在pH>8的流動相條件下,SiO2會溶解,而在pH<2時,鍵合相會逐漸水解,因此硅膠基質固定相能夠穩定使用的pH值范圍相對較窄,不能滿足部分樣品尤其是生物組分和堿性藥物的分離要求。
采用高分子反相固定相時,可根據被分離樣品的分子量大小選擇合適孔徑的固定相。PLRP-S固定相分離肽類和蛋白質時,孔徑為10nm的固定相,適合于分離15~20個氨基酸長度的肽類;孔徑為30nm的固定相,適合于中等分子量的球形蛋白質;孔徑為100nm的固定相,適宜于較大的球狀蛋白質或纖維狀結構的化合物;而孔徑為400nm的超大孔固定相,則可分離很大分子量的樣品。 RPLC中常用的固定相見表1。
表1 RPLC中常用的固定相
固定相 | 特點 |
化學鍵合相 | |
? ? ?C18(十八烷基或ODS) | 穩定性好;保留能力強;用途廣 |
? ? ?C8(辛基) | 與C18相似,但保留能力降低 |
? ? ?C3,C4 | 保留能力弱;多用于肽類與蛋白質分離 |
? ? ?C1[三甲基硅烷(TMS)] | 保留最弱;最不穩定 |
? ? ?苯基,苯乙基 | 保留適中;選擇性有所不同 |
? ? ? —CN(氰基) | 保留值適中;正相與反相均可使用 |
? ? ? —NH2(氨基) | 保留弱;用于烴類;穩定性不夠理想 |
? ? ? 全氟代烷基 | 對鹵代化合物,芳香異構體和其他極性化合物的保留更強 |
非化學鍵相和 | 1<pH<13,流動相中穩定;對某些分離峰形好,柱壽命長 |
聚苯乙烯基石墨化碳 | 0<pH<14,流動相中穩定;可在高溫下使用 |
二、流動相
在反相色譜中,流動相的極性大于固定相極性,溶質按其疏水性大小進行分離,極性越大或疏水性越小的溶質,與非極性的固定相的結合越弱,越先被洗脫。
反相色譜中改變分離選擇性的方法包括:流動相組成、柱類型和柱溫。通過改變流動相組成可以便捷有效地改善分離選擇性。反相色譜流動相通常以水為基礎,加入一定量的能與水互溶的甲醇(MeOH)、乙腈(ACN)、四氫喃(THF)等極性溶劑。選擇不同的有機溶劑不僅影響溶質的保留,對分離選擇性也有影響。
甲醇毒性為乙腈的1/6,價格便宜,是反相色譜中使用最多的非極性溶劑。其給予質子和接受質子的能力最強,氫鍵作用力最大。與甲醇相比,乙腈的溶劑強度較高且黏度低,且可滿足在紫外區185~205nm檢測的要求。四氫呋喃分子體積較大,色散力、疏水作用最強,洗脫強度最大。
流動相的強度隨著溶劑的極性增加而降低。常用溶劑洗脫強度的強弱順序為:
水(最弱)<甲醇<乙腈く乙醇く四氫呋喃<丙醇<二氯甲烷(最強)
對于強疏水性樣品,采用100%乙腈仍無法洗脫時,可考慮采用更強的流動相(如高百分比的THF—H2O體系或THF—ACN體系)。除二氯甲烷與水無法混溶外,上述其他濃、與水混用。二氯甲烷常用來清洗被強保留樣品污染的反相色譜柱。甲醇、乙晴和四水的混合物的洗脫強度之間存在以下經驗換算關系:
θ乙腈=0.32θ2甲醇+0.57θ甲醇
θ四氫呋喃=0.66θ甲醇
其中,θ甲醇、θ乙腈?、θ四氫呋喃分別為乙腈、甲醇和四氫呋喃與水混合溶劑的體積分數。上,除了考慮洗脫強度外,還必須考慮分離選擇性的變化。
流動相中不含水的分離模式稱為非水反相色譜(NARP),主要用于保留極強或即使采100%乙腈仍難以洗脫的強疏水性樣品的分離。NARP流動相通常為極性不同的兩種有染的混合液。一般來說,高極性的溶劑采用乙腈或甲醇,低極性溶劑采用四氫呋喃、氯仿、氯甲烷、丙酮等。通過改變兩種有機溶劑的比例或溫度可有效控制樣品的保留強弱。由于用二氯甲烷等溶劑限制了低波長UV檢測的應用,且正相色譜能夠方便地分離強極性樣品通常情況下不推薦采用NARP。
三、方法發展
在建立反相液相色譜方法時,初始實驗通常采用普適性較好的C8或C18柱。色譜柱應具有適當的反壓(<2500pSi)、合理的柱效(N>8000)、運行時間短(<15min)。通常采用046cm×15cmX5μmC18或C8柱。進樣前用10倍柱體積流動相平衡以保證實驗的重現性為獲得較低的柱壓和較高的柱效,初始柱溫可設定為35℃或40℃,沒有柱溫箱的情況下則在室溫下測定。為保證檢測靈敏度,初始進樣量可設為25~50μl,方法優化后根據柱尺寸減小至所需值(如采用?
θ內0.4~0.5cm色譜柱時,進樣量應小于25μl或10μg)
采用反相液相色譜法可通過改變流動相種溶劑種類、濃度(B%)和柱溫等參數實現多數樣品的分離。初始流動相pH通常選取較低pH值(pH=2~3),這是因為在低pH下,硅羥基質子化從而可以降低其活性。此外,由于與常見酸堿官能團pKa相差較遠,具有酸堿性樣品的保留不會受到pH值微小變化的影響。方法優化過程中如需對pH進行優化,應在其他條件優化后進行。
綜上所述,對于中性樣品,初始條件為15cm×5μmC18或C8柱,乙腈-水流動相,2 ml/min流速,柱溫35℃或40℃,梯度設置采用5%~100%乙腈,6min;對于離子型樣品,流動相水相改為25~50mol/L磷酸緩沖溶液(pH=2~3);對于中性和離子型共存的樣品,采用后者作為流動相。
根據初始條件獲得的色譜圖可以初步判斷所需要發展的方法采用等度洗脫或梯度洗脫。如果所有組分均在相對較窄的梯度時間內集中流出,則說明后續實驗可采用等度洗脫。由梯度保留值范圍比梯度時間可以估算等度條件下色譜柱及流速的保留值范圍。例如,令最后被洗脫的組分和第一個被洗脫的組分保留時間之差為△tR,梯度時間為tC,當tR/tC=0.25時,對應的等度保留值范圍為1<k'<10;當△tR/tC=0.40時,對應的等度保留值范圍為0.5<k'<20。當等度保留值在0.5<k'<20范圍之內時,可采用等度分離條件,等度分離的B%根據初始梯度條件下最后一個流出色譜柱組分的保留時間決定。
采用梯度洗脫時,以初始梯度實驗第一個流出色譜柱組分對應B%作為推薦梯度的初始B%,以最后一個流出色譜柱組分對應的B%作為推薦梯度的最終B%。接下來可通過改變梯度實現樣品的更好分離。
在初始條件下保留較弱的組分通常為以離子形態存在的堿性溶質(pPH=2~3),分離效果較差。對pKa<8的弱堿性溶質,可通過增大流動相pH值提高其保留值;但對堿性較強的溶質,則需加入磺酸鹽離子對試劑增加其保留值。而對初始條件下難以洗脫的強保留組分,可采用四氫呋喃-水體系進行洗脫、非水反相分離或改成正相色譜模式進行分離。
向流動相中加入改性劑主要有兩種方法。
(1)離子抑制法在反相色譜中常向含水流動相中加入酸、堿或緩沖溶液,以使流動相的PH控制一定數值,抑制溶質的離子化,減少譜帶拖尾,改善峰形,以提高分離的選擇性例如在分析有機弱酸時,常向甲醇-水流動相中加入19%的甲酸(或乙酸、三氯乙酸、H3PO4、H2SO4),就可抑制溶質的離子化,獲對稱的色譜峰。對弱堿性樣品,向流動相中加入1%的三乙胺也可達到相同的效果。
(2)離子強度調節法在反相色譜中,在分析易離解的堿性有機物時,隨流動相pH值的增加,鍵合相表面殘存的硅羥基與堿的陰離子的親和能力增強,會引起峰形拖尾并干擾分離,此時若向流動相中加入0.1%~1%的乙酸鹽或硫酸鹽、硼酸鹽,就可利用鹽效應減弱殘存硅羥基的干擾作用,抑制峰形拖尾并改善分離效果。但應注意經常使用磷酸鹽或鹵化物會引起硅烷化固定相的降解。
顯然,向含水流動相中加入無機鹽后會使流動相的表面張力增大,對非離子型溶質,會引起保留值增加:對離子型溶質,會隨鹽效應的增加引起保留值的減小。




















