榮昌生物維迪西妥單抗尿路上皮癌適應癥上市申請獲受理
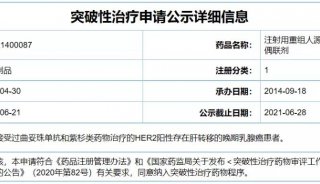
7月14日,榮昌生物維迪西妥單抗用于治療HER2過表達局部晚期或轉移性尿路上皮癌患者的新藥上市申請,正式獲國家藥監局受理。這是繼上個月首個適應癥獲批上市銷售之后,維迪西妥單抗迎來的又一重磅消息。
在此之前,這款中國自主研發的首個ADC新藥,已先后獲得美國藥監局和中國藥監局授予的突破性療法認證,成為首個拿到美、中兩國突破性療法雙重認定的ADC藥物,也是至今唯一一個拿到FDA突破性療法認定的囯產ADC藥物,而獲認定的正是尿路上皮癌適應癥。
尿路上皮癌是世界范圍內排名第九的常見惡性腫瘤,其發病率及死亡率均占男性泌尿生殖系統腫瘤的首位,且逐年上升。根據弗若斯特沙利文報告,全球新增尿路上皮癌病例于 2030 年將達到約 66.2 萬例,2025 年至 2030 年復合年增長率為 2.5%;在中國,尿路上皮癌的發病率增速高于全球水平,預計于2030年將達到約 10.6 萬例。統計顯示,該病復發率和轉移率較高,約20%的患者確診時已發生轉移或病程已進展至不可切除階段,現有治療手段遠未滿足巨大的臨床需求。
維迪西妥單抗是中國第一個提交上市申請的靶向HER2治療尿路上皮癌的ADC藥物。今年6月,全球最權威腫瘤學術盛會ASCO年會召開,榮昌生物亮相盛會的最新研究顯示,維迪西妥單抗對經過二線及以上系統化療的尿路上皮癌適應癥患者均有突出療效和生存獲益,獨立影像學評估的客觀有效率達到50%,中位無進展生存時間為5.1個月,中位生存時間為14.2個月;聯合PD-1單抗治療一線轉移性尿路上皮癌療效驚人,在HER2有表達的病人中,客觀緩解率達到100%,有望實現尿路上皮癌一線治療的重大突破。

在尿路上皮癌適應癥遞交上市申請之前,維迪西妥單抗首個適應癥已于今年 6 月 9日獲國家藥監局( NMPA)批準上市銷售,用于至少接受過2種系統化療的HER2過表達局部晚期或轉移性胃癌(包括胃食管結合部腺癌)患者的治療。維迪西妥單抗獲批,打破了ADC藥物領域無原創國產新藥的局面,填補了全球HER2過表達胃癌患者后線治療的空白,是我國自主創新生物藥發展史上的一個里程碑。
-
儀器推薦

-
儀器推薦

-
儀器推薦

-
儀器推薦

-
儀器推薦

-
會議會展

-
會議會展

-
科技前沿

-
科技前沿
-
科技前沿
-
產品技術
















