均相化學發光技術的前世今生
二十一世紀隨著生命科學技術的飛速發展,臨床化學免疫分析經歷了放射免疫,酶聯免疫到現在的化學發光免疫,檢測技術的一步步革新將原來的手工操作帶入了全自動檢測時代,其檢測結果的精密度和準確度也越來越高。
其中90年代初由美國科學家Ullman教授發現,并由美國德靈公司開發的LOCI(Luminescent oxygen channeling immunoassay)診斷技術,以其獨特的能量轉移機制和化學發光原理實現了均相免清洗,快速,高靈敏和高通量檢測,并可應用于基礎醫學研究,DNA分子檢測,食品安全以及新藥開發等領域。
美國PerkinElmer公司則基于該技術開發的Alphascreen/Alphalisa至今在藥物篩選方面扮演著重要的角色。遺憾的是隨著德靈公司在2007年被西門子診斷以70億美金收購后,LOCI技術的發展創新出現了停滯。
而在國內由趙衛國博士于2004年創建的博陽生物(后被科美診斷于2014年收購)首次將該技術引進國內,并開發了高通量的大型化學發光系統LICA技術平臺,其在傳染病項目上表現非常出色。隨后于2016年成都愛興生物在LOCI技術的基礎上做了進一步創新,提升了單體氧的能量轉化效率并將其應用于均相化學發光POCT系統,已取得7項產品注冊證,并自主擁有核心原料和相關知識產權。
西門子診斷基于LOCI技術集成了生化和免疫一體機Dimension平臺
科美診斷的LICA500光激化學發光平臺
愛興生物的LIA-12均相化學發光POCT檢測平臺
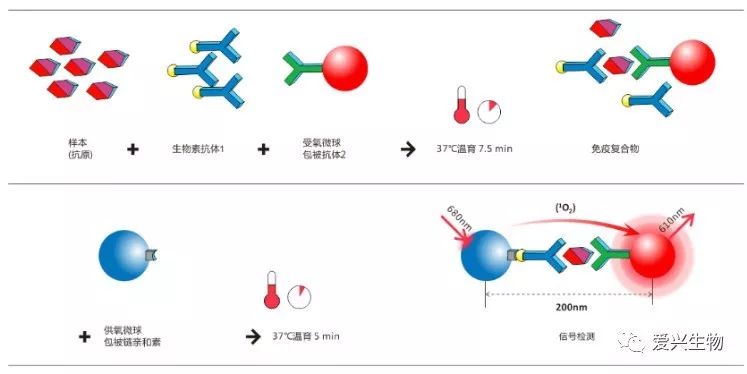
均相化學發光技術是一種基于兩個納米微球利用單線氧能量的短距離擴散,激發已形成的相鄰位點的化學發光反應來測定生物分子之間的相互作用,它最關鍵的特征在于它是一種非放射性的,均相的檢測分析方法,由捕獲微球上生物分子的近距離結合,從一個微球到另一個微球發生了能量轉移,通過化學反應并最終產生發光信號。
要了解信號是如何產生的,必須從了解微球開始。
每個發光測定包含兩種微球類型:供氧微球和受氧微球。其中兩種微球的表面都修飾了多糖水凝膠,使其非特異性結合和自聚集降低到最小化,并帶有大量的活性基團便于和生物分子進行化學偶聯。
微球是乳膠基質,直徑200nm相比較基于磁珠(一般是1um和3um)的化學發光,其微球表面積成倍的增加,通常以比磁珠低得多的濃度使用,可以偶聯更多的生物分子,在成本效應方面有顯著的優勢。微球密度(1.05g/cm3)接近于水,可以永久在水相中呈懸浮狀態而不會沉淀在生物緩沖液中,并且可以使用自動液體處理裝置容易地分配微球懸浮液而不會堵塞針頭。
微球試劑可通過離心或者超濾來清洗,偶聯生物分子后的純化不需要色譜分離,從而獲得高產率和易用性。此外即使在高溫下(例如PCR用于95℃)以及凍干形式,微球試劑的表現也是非常穩定的。
均相發光原理基于每種微球內部都填充了不同的化學有機染料混合物,供氧微球含有光敏劑酞菁染料,在680nm紅光的照射下,將周圍環境里的氧分子轉化成一種高能態活躍的單體氧(SingletOxygen)。
請注意,單體氧不是自由基,它是具有單個激發電子的單線態氧,與其他受激發分子一樣,供氧微球釋放出來的60000個單線態氧在回落到基態之前的壽命有限,在其4微秒半衰期內,它可在溶液中擴散的距離約為200nm。當待測物質與雙抗體發生免疫反應,形成免疫復合物,其中的受氧微球與供氧微球距離小于200nm,單線態氧就會觸發受氧微球里的二甲基噻吩衍生物和稀土螯合物,繼而通過一系列的化學反應,最終在610nm左右產生很強的光信號。
光信號與被檢測物濃度呈正相關,儀器通過濃度-相對發光值(RLU)的校準曲線,即可計算出樣本中待測物質的濃度。如果樣本中沒有待測物質,供氧微球與受氧微球的距離將大于200nm,單線態氧降至基態且不產生信號,所以不用任何清洗,也不會帶來任何的背景干擾。
均相化學發光技術集合了有機化學、高分子材料,免疫學、分子生物學,激光技術、氧自由基能量傳遞技術等優點,相較其他分析檢測技術有著突出的優勢。
高靈敏度,寬檢測范圍
發光信號(以每秒計數,或cps)是級聯反應,其由于供氧微球內部的高濃度光敏劑在680nm激發下,每個供氧珠每秒可以釋放多達60,000個單線態氧分子,從而產生非常高的信號放大。由于信號放大級聯反應產生的強信號,它能夠檢測低至飛摩爾濃度的生物結合發生的分子相互作用。
非常低的背景
背景非常低(空孔大概100 – 200cps ),這有三個原因:
首先,以時間分辨模式進行測量,這幾乎消除了所有熒光背景。
?其次,讀取信號的波長615nm低于激發波長680nm,存在上轉換模式,避免了如血紅蛋白、膽紅素等雜質對檢測信號的干擾,并最大程度降低了檢測信號的背景值。?
第三,由于照射波長在680nm處非常長,因此很少有生物或測定物質會干擾,幾乎沒有來自背景的自發熒光,這使得均相發光技術成為了一種高度靈敏和強大的分析技術。
精密度好
均相發光的發光效應取決于單分子氧的能量傳遞,而光敏劑和發光劑并不產生損耗,在一定時間內可重復檢測,結果非常穩定。由于免除了非常復雜的磁珠清洗步驟,所以精密度有了很大的提升,其綜合CV可以達到5%以內甚至更低。
?
小型化
均相發光技術可以輕松實現小型化,樣本量理論可以低至5μL或更低,并不會改變試劑濃度,無需進行分析重新優化,也不會犧牲分析穩定性,只需將所有試劑的絕對量減少相同的百分比,然后將其轉移到微孔中進行測定即可。
成本效益
由于均相發光產生的光信號極高,所以S/N信噪比就會表現突出,由于這種強信號低背景組合,其成本優勢也是非常明顯的,加上不需要清洗液、激發液、底物液,極大降低了耗材成本。
技術多樣性和通用性強
使用均相發光技術可以實現分析設計的極佳多功能性,酶活性,受體-配體相互作用,低親和力相互作用,功能性GPCR研究,DNA,RNA,蛋白質,肽,碳水化合物,小分子,大分子或具有極大不同大小的結合伴侶都可以用均相發光技術來測定。一般的而言每個微球受體的數量是300-500個抗原抗體,2000-4000鏈霉親和素或400-700寡聚核苷酸。
分子診斷的應用
簡單操作和低成本的檢測核酸目標物在分子診斷中仍然是一個挑戰,均相發光技術可以與合成的寡聚脫氧核苷酸結合,并通過連接探針與不同的DNA靶分子進行雜交。這些接有寡聚物的LOCI顆粒在PCR(聚合酶鏈反應)反應中能夠在熱循環中存活下來并且可以通過實時和終點法對DNA目標分子進行定量檢測,可以有效的控制PCR攜帶污染和易于自動化的雙重優點。
當然,均相化學發光技術也不是一個完美的技術,它也存在著一定的缺陷和不足之處。
譬如光氧微球都有其理論上的最大結合力,當微球達到最大結合力時,結合的蛋白處于飽和狀態,任何多余的蛋白都不會在與微球結合。當微球達到飽和狀態時,就會產生“鉤狀效應”(hook effect),它是一種常見的現象,普遍存在于任何使用雙抗體夾心法的檢測實驗中(例如ELISA實驗),加上該技術徹底的免清洗,所以對于需要間接法或者酶動力學實驗的檢測是無法進行的。
但對大部分項目而言,高濃度的檢測已經沒有太大意義,臨床也很少會碰到這種情況,并可以通過對試劑或者樣本稀釋拉伸作用來減少這種干擾。
總之,均相化學發光技術是一種靈敏的檢測方法。由于其均相、免清洗的技術優勢,使得檢測結果精準,檢測更加快速便捷,它能夠提供更寬泛的動態范圍,更敏感的檢測低結合力物質間的相互作用,它可以進行多種檢測方式的組合,可重復,成本低,易于智能化,自動化。
未來隨著廠家和相關領域的科研工作者對LOCI技術的不斷探索和發掘,其應用范圍也會越來越廣,筆者相信在不久的將來均相化學發光技術或將成為繼酶促化學發光、直接化學發光、電化學發光之后主流的化學發光檢測方法學之一。